Перейти к:
Гиперкальциемия с развитием хронической болезни почек, нефролитиаза после введения масляных растворов в мышцы
https://doi.org/10.14341/osteo13141
Аннотация
Одной из редких причин паратгормон-независимой гиперкальциемии может быть использование культуристами, наряду с анаболическими гормонами, инъекций масляных растворов в мышцы для большей их рельефности. Представлен клинический случай пациента 43 лет, использовавшего масляный раствор синтола в возрасте 25–30 лет, с длительно нераспознанной гиперкальциемией, манифестировавшей нефролитиазом и развитием хронической болезни почек (ХБП). Гиперкальциемия впервые выявлена в 37 лет, но была оставлена без внимания. При обследовании в 2023 г. (в 43 года) гиперкальциемия достигла критического уровня (4,26 ммоль/л) при сниженном паратгормоне (ПТГ) и ХБП С4. Поиск онкологических причин гиперкальциемии не дал результата. Доказана редкая причина гиперкальциемии — введение масляного раствора в мышцы, что привело к нефролитиазу, нефрокальцинозу и ХБП. Продемонстрирован положительный эффект глюкокортикоидов по аналогии с таковым при гранулематозных заболеваниях и гиперкальциемии. Обсуждаются механизмы развития ПТГ-независимой гиперкальциемии и дифференциальной диагностики. Представленный клинический случай редкой причины гиперкальциемии может быть полезен для врачей разных специальностей: эндокринологов, терапевтов, урологов, дерматологов и др.
Для цитирования:
Рунова Г.Е., Пешева Е.Д., Вастистова А.А., Рожинская Л.Я., Полубояринова И.В., Василевская М.П., Гурова О.Ю., Фадеев В.В. Гиперкальциемия с развитием хронической болезни почек, нефролитиаза после введения масляных растворов в мышцы. Остеопороз и остеопатии. 2023;26(3):33-39. https://doi.org/10.14341/osteo13141
For citation:
Runova G.E., Pesheva E.D., Vastistova A.A., Rozhinskaya L.Ya., Poluboyarinova I.V., Vasilevskaya M.P., Gurova O.Yu., Fadeev V.V. Hypercalcemia with the development of chronic kidney disease, nephrolithiasis after intramuscular injection of oil solutions. Osteoporosis and Bone Diseases. 2023;26(3):33-39. (In Russ.) https://doi.org/10.14341/osteo13141
АКТУАЛЬНОСТЬ
Гиперкальциемия среди амбулаторных пациентов наиболее часто обусловлена первичным гиперпаратиреозом, частота которого во взрослой популяции составляет 1:1000 [1]. Различают паратгормон (ПТГ) -зависимую и ПТГ-независимую гиперкальциемии. Наиболее распространенным вариантом гиперкальциемии вследствие гиперпродукции ПТГ является первичный гиперпаратиреоз [1], который среди амбулаторных пациентов с гиперкальциемией составляет до 90% случаев. Среди ПТГ-независимых гиперкальциемий чаще встречается гуморальная гиперкальциемия, связанная с различными онкологическими заболеваниями и их осложнениями. Среди госпитализированных пациентов более 50% случаев гиперкальциемии обусловлено опухолями [2]. Более редкие варианты ПТГ-независимой гиперкальциемии ассоциированы с витамином D и включают в себя интоксикацию витамином D, как правило связанную с его передозировкой, гранулематозные заболевания и эндогенные нарушения метаболизма витамина D [3][4]. Наряду с интоксикацией витамином D, значительно более редкой причиной гиперкальциемии, индуцированной экзогенным воздействием может быть введение масляных растворов в мышцы. Механизм развития гиперкальциемии в данном случае схож с таковым при гранулематозных заболеваниях, а по последствиям и влиянием на почки — с редким наследственным аутосомно-рецессивным заболеванием, связанным с нарушением инактивации витамина D в результате мутаций в гене CYP24A.
Синтол — это масляный раствор, состоящий на 85% из среднецепочечных жирных кислот, бензилового спирта (7,5%) и лидокаина (7,5%). Среди бодибилдеров существует практика внутримышечного введения синтола в область бицепсов, квадрицепсов, ягодичных мышц с целью увеличения их объема [5–12]. Заполняя межфасциальные пространства и вызывая отек, синтол приводит к визуальному увеличению мышц, не влияя на силовые показатели. В зависимости от суммарного количества, препарат вызывает острое или хроническое воспаление с формированием гранулем инородных тел, состоящих преимущественно из макрофагов и гигантских клеток инородных тел. В дальнейшем происходит деструкция и фиброз мягких тканей, чему способствует медленная деградация синтола и миграция по межфасциальным пространствам [9][10][13–15].
В литературе описаны различные последствия внутримышечного применения синтола: тяжелая гиперкальциемия, не ассоциированная с гиперпаратиреозом, нефрокальциноз, снижение скорости клубочковой фильтрации, изъязвление и некроз кожи, местные гнойные осложнения [5][7][8–12][16–18]. Данные исследования, проведенного в 2021 г. с участием 88 мужчин, подтвердило, что факторами риска развития гиперкальциемии являются суммарный объем препарата, инъекции нагретых растворов и высокий уровень антител к рецептору IL-2 в сыворотке крови [8]. Также высокое соотношение 1,25(OH)2D3/25(OH)D3 в сочетании с гиперкальциурией и низким уровнем паратиреоидного гормона (ПТГ) были ассоциированы с развитием мочекаменной болезни [9][19].
В норме при повышении уровня кальция ПТГ тормозит активность 1α-гидроксилаза почек, снижая синтез витамина D и, соответственно, уменьшая всасывание кальция из кишечника и его реабсорбцию в почечных канальцах. При гранулематозных заболеваниях 1α-гидроксилаза макрофагов функционирует автономно, что приводит к развитию гиперкальциемии [19][20].
В данной работе представлен клинический случай синдрома гиперкальциемии, сопровождавшегося развитием мочекаменной болезни и снижением функции почек на фоне длительного применения внутримышечных инъекций синтола в анамнезе.
ОПИСАНИЕ СЛУЧАЯ
Мужчина, 43 года, поступил в эндокринологическое терапевтическое отделение №1 Университетской клинической больницы №2 ПМГМУ им. И.М. Сеченова (Сеченовский Университет) в феврале 2023 г. с жалобами на интенсивные боли во всем теле, слабость, утомляемость, снижение массы тела. Из анамнеза известно, что с раннего подросткового возраста занимался различными видами спортивных единоборств. С 2010 до 2016 гг. (с 25 лет до 31 года) регулярно использовал анаболические стероиды, препараты тестостерона (Нандролон, Сустанон, Винстрол, Андролик, Метандиенон), а также вводил масляные растворы (синтол) в плечи и бедра (рис. 1. Места инъекций масляных растворов).
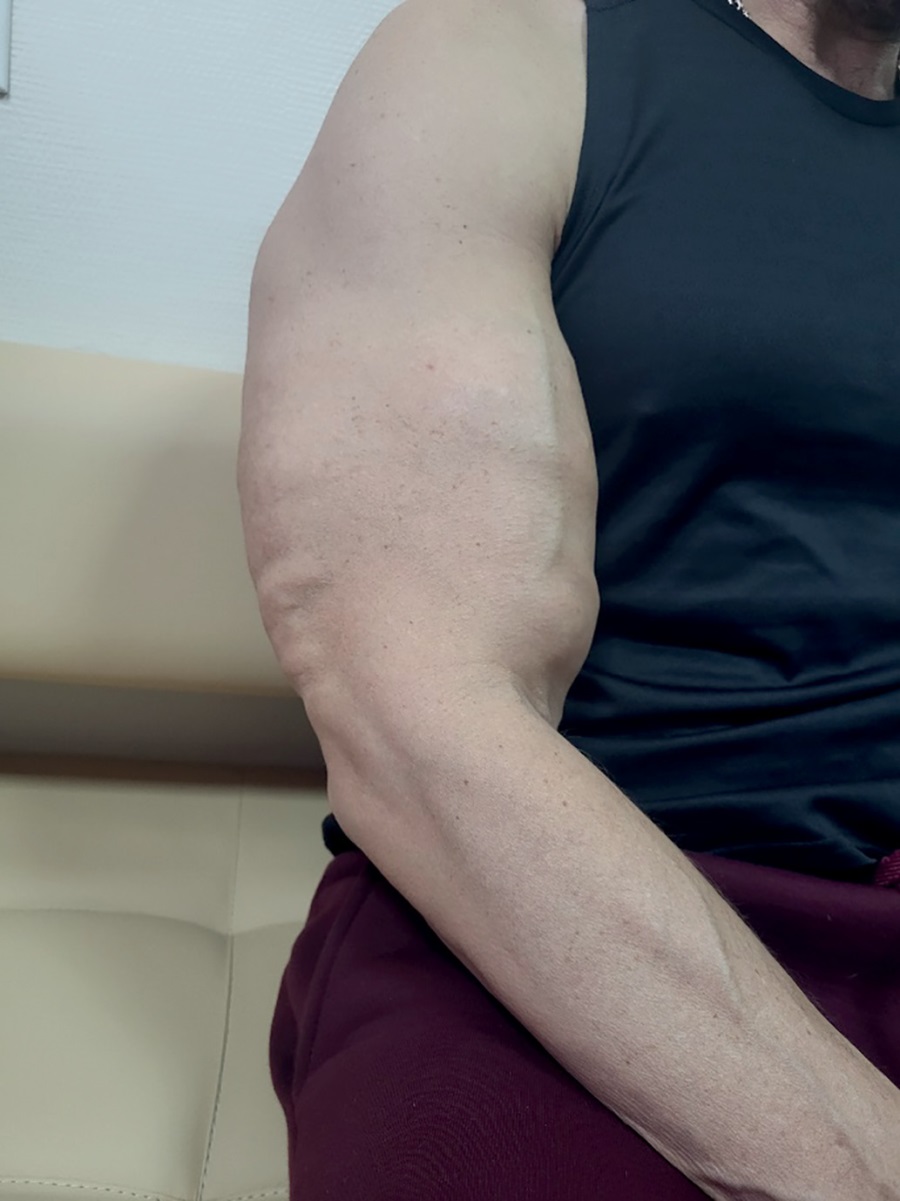
Рисунок 1. Места инъекций масляных растворов.
В 2012 г. впервые возникла почечная колика, в дальнейшем конкременты отходили самостоятельно, у уролога по месту жительства не наблюдался. По данным компьютерной томографии (КТ) органов брюшной полости и забрюшинного пространства, в 2019 г. выявлены конкременты обеих почек, уростаз слева. Выполнено удаление конкремента левого мочеточника с последующим стентированием. В дальнейшем — периодическое самостоятельное отхождение конкрементов. По данным ультразвукового исследования (УЗИ) в январе 2023 года: в проекции верхней и нижней чашек левой почки определяются камни размерами: слева — 7 мм, в нижней чашке — 6 и 10 мм. В обеих почках определяются кисты до 10 мм. В проекции лоханки правой почки по медиальному контуру определяется киста с неровными контурами размерами 45х51 мм.
С 2016 по февраль 2022 гг. отмечает снижение массы тела на 40 кг на фоне привычных физических нагрузок и рациона питания (90 кг, ИМТ 26 кг/м²). Также в 2016 г. возникли интенсивные боли в костях (по визуально-аналоговой шкале (ВАШ) боли 10 баллов), по поводу чего ежедневно принимал нестероидные противовоспалительные препараты (НПВП) (как правило, комбинацию диклофенака/ибупрофена с кетопрофеном) не менее 5 раз в сутки с кратковременным положительным эффектом.
В 2017 г. при обследовании впервые диагностирована ХБП С4: креатинин — 350 мкмоль/л (57–115), рСКФ по CKD-EPI: 17,3 мл/мин/1,73 м², мочевина 16,5 ммоль/л (2,8–7,2). В сентябре 2020 г.: креатинин: 342 ммоль/л (57–115), рСКФ по CKD-EPI: 17,9 мл/мин/1,73 м², мочевина — 22,3 ммоль/л (2,8-7,2), альбумин — 40 г/л (35-52), мочевая кислота — 573 ммоль/л (208–428), кальций ионизированный — 1,69 ммоль/л (1,16–1,32). В 2017 г. впервые выявлена анемия (гемоглобин — 106 г/л), уровень сывороточного железа — 13,7 мкмоль/л (12,2–32,2). Рекомендована терапия препаратами эритропоэтина.
В 2020 г. впервые проведено обследование по поводу выраженной гиперкальциемии (кальций общий — 4,26 ммоль/л) при уровне паратгормона 26,2 пг/мл (15–65). По данным УЗИ щитовидной железы, околощитовидных желез в 2022 г.: объем щитовидной железы — 11,86 см³, единичные анэхогенные включения размером 2–3 мм с микрокальцинатом в центре. Проведена рентгеновская денситометрия правого бедра в ноябре 2022 г.: Z-критерий на уровне шейки бедренной кости: +3,2 SD; поясничного отдела позвоночника L1-L4 +2,5 SD; костей правого предплечья +0,7 SD.
С целью исключения паранеопластической гиперкальциемиии в 2020 г. проведено обследование: по данным сцинтиграфии костей скелета, очаги гиперфиксации радиофармпрепарата (РФП) не выявлены; выявлено повышенное накопление РФП в суставах верхних и нижних конечностей. По данным рентгенографии костей таза, в ноябре 2022 г. выявлены множественные кальцификаты мягких тканей; по данным рентгенографии черепа, травматические и деструктивные изменения отсутствуют; по данным рентгенографии органов грудной клетки, выявлены признаки хронического неспецифического заболевания легких (эмфизематозные легочные поля, тяжисто-фиброзные изменения легочного рисунка нижних долей легких с плевродиафрагмальными спайками, уплотнены лимфоузлы бронхопульмональной, бифуркационной групп).
Эзофагогастродуоденоскопия (ЭГДС) в июне 2022 г.: поверхностный гастрит. Видеоколоноскопия в июле 2022 г.: органической патологии не выявлено.
В январе 2023 г. проходил стационарное лечение в отделении искусственной почки УКБ №3 Сеченовского Университета. В связи с выявленной гиперкальциемией в стационаре начат форсированный диурез (0,9% р-р NaCl+фуросемид). На этом фоне было отмечено снижение уровня кальция, скорректированного на альбумин, до 3,2–3,3 ммоль/л. У пациента предположено развитие гиперкальциемии на фоне гранулем вследствие внутримышечных инъекций масляных растворов. Проведено исследование уровня метаболитов витамина D (табл. 1). Начат курс лечения преднизолоном, 15 мг в сутки, также назначена терапия: фебуксостат — 80 мг в день; бисопролол — 5 мг в день, амплодипин — 10 мг в день, фуросемид — 40 мг в день, омепразол — 20 мг в день, севеламера карбонат — 2,4 г в день, кетоаналоги аминокислот — по 5 таблеток 3 раза в день, железа (III) гидроксид полимальтозат 100 мг по 2 таблетки. в день.
Таблица 1. Результаты исследования 25 (ОН)D3
и других метаболитов витамина D пациента
методом высокоэффективной жидкостной хроматографии
с тандемным масс-спектрометрическим детектированием.
Исследование выполнено в лаборатории метаболомных исследований
ФГБУ «НМИЦ эндокринологии» МЗ РФ
|
Метаболиты витамина D |
Показатель |
РИ |
|
25(ОН)D3, нг/мл |
13,7 |
20,0–60,0 |
|
25(ОН)D2, нг/мл |
0,8 |
20,0–60,0 |
|
общий 25(ОН)D, нг/мл |
15 |
20,0–60,0 |
|
3-epi-25(OH)D3, нг/мл |
0,5 |
1,0–10,0 |
|
24, 25(ОН)2D3, нг/мл |
<0,3 |
0,5–5,6 |
|
25(ОН)D3/24,25(ОН)2D3 |
68,5 |
7,0–25,0 |
|
1,25(ОН)2D3, пг/мл |
16,80 |
18,0–64,0 |
В феврале 2023 г. при осмотре в эндокринологическом терапевтическом отделении №1 УКБ №2 Сеченовского Университета: масса тела — 89 кг, рост — 186 см, ИМТ — 25,2 кг/м². Мягкие ткани плеч выраженно увеличены, отмечается неровность контура, при пальпации бицепса и трицепса — каменистая плотность. Обращают внимание множественные узелковые подкожные образования по всему телу (на правом бедре, груди, ногах). Подкожно-жировой слой развит недостаточно, распределение равномерное.
В клинике диагностирована гиперкальциемия на фоне формирования гранулем (внутримышечное введение масляных растворов). Хронический тубулоинтерстициальный нефрит смешанной этиологии (уратной, лекарственной, инфекционной). Мочекаменная болезнь: конкремент левой почки. ХБП С3б. Нефрогенная анемия. Хронический рецидивирующий пиелонефрит, ремиссия. Артериальная гипертензия 3 степени повышения АД, риск 3. Поверхностный гастрит вне обострения. В клинике продолжена проводимая терапия, доза преднизолона увеличена до 25 мг в день.
При неврологическом осмотре выявлена уступчивость при проверке силы в мышцах левого бедра. Проведена игольчатая и стимуляционная электронейромиография, по данным которой подтвержден невральный уровень поражения, выявлены признаки фибулярного канала с двух сторон, кубитального канала слева. Назначен габапентин — 300 мг 1 табл. 1 раз в 2 дня (с учетом сниженной СКФ).
На фоне проводимого лечения пациент отметил снижение интенсивности болевого синдрома, что позволило снизить кратность приема НПВП до двух раз в день (ибупрофен+кетотифен+дротаверин).
Результаты лабораторных исследований за время заболевания представлены в таблице 2.
Таблица 2. Результаты лабораторных исследований
до и во время госпитализации в клинике Сеченовского Университета
|
2017 |
2020 |
01.2023 |
07.02.23 |
14.02.23 |
21.02.23 |
РИ |
|
|
ПТГ, пг/мл |
26,2 |
17,3 |
10,4 |
15–65 |
|||
|
Са (общ.), ммоль/л |
4,26 |
4,26 |
2,94 |
2,87 |
2,42 |
2,1–2,55 |
|
|
Са (скор.), ммоль/л |
4,3 |
3,0 |
2,95 |
2,42 |
2,1–2,55 |
||
|
Са (ион.), ммоль/л |
1,69 |
1,47 |
1,16–1,32 |
||||
|
Р, ммоль/л |
1,22 |
1,68 |
1,22 |
1,39 |
0,81–1,45 |
||
|
Mg, ммоль/л |
0,66 |
0,73–1,06 |
|||||
|
ЩФ, ед/л |
43 |
30–120 |
|||||
|
Креатинин, мкмоль/л |
350 |
342 |
305 |
323 |
259 |
265 |
57–115 |
|
рСКФ по СKD-EPI |
17,4 |
17,9 |
20,5 |
19,2 |
25 |
24,3 |
|
|
Экскреция мочи: •Са, ммоль/сут •Креатинин, ммоль/сут •Скорость фильтрации, мл/мин |
7,3 12,51 33 |
16,24 42,8 |
0–7,5 7,1–17,7 |
Примечание: ПТГ — паратиреоидный гормон;
Са (общ) — общий кальций; Са (ион.) — ионизированный кальций;
Р — фосфор; Mg — магний; ЩФ — щелочная фосфатаза;
рСКФ — расчетная скорость клубочковой фильтрации.
Как видно из табл. 1 и 2, до лечения у пациента на фоне гиперкальциемии, низко-нормального паратгормона (ПТГ), ХБП 4 при СКФ 17–20 мл/мин имеется гиперкальциурия (относительно низкой СКФ) на фоне дефицита общего витамина D, при этом отмечаются сниженные уровни 1,25(ОН)2D3 и 24-25-дигидроксивитамин-D3 (24,25(ОН)2D3), при повышенном соотношении 25-ОН-D3/24,25(ОН)2D3.
После достижения стойкой нормализации уровня кальция в крови была предпринята попытка снижения дозы преднизолона с 25 мг до 20 мг в сутки. Тем не менее в связи с повторным повышением уровня кальция до 2,8 ммоль/л, возобновлена прежняя схема приема препарата. После нормализации уровня кальция в крови предпринята повторная попытка снижения дозы преднизолона на 2,5 мг каждые 10–14 дней под контролем уровня кальция и креатинина крови. На момент написания работы пациент получал преднизолон в дозе 17,5 мг в день в течение месяца. Результаты лабораторных исследований в динамике представлены в таблице 3.
Таблица 3. Результаты лабораторных исследований в динамике
|
Дата |
Са (общ) |
Са 2+ (ион) |
Альбумин |
P (фосфор) |
Креатинин, |
рСКФ |
Преднизолон, мг |
|
03.03. |
2,59 |
1,39 |
38 |
1,22 |
268 |
24 |
25 |
|
14.03. |
2,48 |
39 |
1,41 |
249 |
26 |
20 мг |
|
|
23.03 |
2,62 |
1,42 |
39 |
1,39 |
264 |
24 |
15 мг |
|
04.04. |
2,86 |
41 |
1,83 |
302 |
20 |
20 мг |
|
|
18.04. |
1,3 |
240 |
27 |
25 мг, постепенное снижение на 2,5 мг |
|||
|
28.04 |
1,2 |
222 |
30 |
17,5 мг |
|||
|
20.05 |
2,52 |
38 |
1,11 |
312 |
20 |
||
|
02.06 |
2,6 |
1,37 |
268 |
24 |
ОБСУЖДЕНИЕ
Первое место среди причин гиперкальциемии занимает первичный гиперпаратиреоз (ПГПТ), который диагностируется на основании повышенного уровня кальция и повышенного или высоко-нормального уровня паратиреоидного гормона (ПТГ). Подавленный уровень ПТГ у пациента позволил исключить ПГПТ как причину выраженной гиперкальциемии.
К ПТГ-независимой гиперкальциемии могут приводить следующие состояния/заболевания: терапия опухолей, иммобилизация, болезнь Педжета, гипертиреоз, гипервитаминоз D (передозировка препаратами витамина D, гранулематозные заболевания), прием лекарственных препаратов (тиазидные диуретики, интоксикация витамином А, молочно-щелочной синдром), острая надпочечниковая недостаточность (ОНН), хроническая надпочечниковая недостаточность (ХНН), острая почечная недостаточность (ОПН), метафизарная хондродисплазия Янсена, а также врожденный дефицит лактазы.
Прежде всего была исключена паранеопластическая гиперкальциемия на основании результатов сцинтиграфии всего тела, рентгеновского исследования костей скелета, электрофореза белков плазмы. Подробно собран лекарственный анамнез, что позволило исключить прием тиазидных и тиазидоподобных диуретиков, активных метаболитов витамина D и токсических доз нативного витамина D. Также у пациента не было данных относительно наличия болезни Педжета, гипертиреоза, ОНН, ХНН, ОПН, метафизарной хондродисплазии Янсена и врожденного дефицита лактазы.
Одной из причин гиперкальциемии при подавленном значении ПТГ может быть избыточная продукция витамина D, обусловленная гранулематозными и редкими генетическими заболеваниями [17]. При гранулематозных заболеваниях макрофагальная 1α-гидроксилаза функционирует автономно, приводя к избыточному накоплению активных форм витамина D и развитию гиперкальциемии, что подтверждено в исследовании EbbeEldrup и соавт. 2021 года. Авторы провели иммуногистохимическое (ex vivo) исследование образцов гранулематозной ткани трех мужчин с тяжелой гиперкальциемией, возникшей после внутримышечных инъекций масляных растворов. Было отмечено, что провоспалительные цитокины (ФНО-α, ИЛ-2) усиливают активность 1α-гидроксилазы и тормозят 24-гидроксилазу. В результате соотношение метаболитов витамина D было смещено в сторону образования активных форм — продукция 1,25(ОН)2D3 составила более 50 пг/мл [16]. Тяжесть гиперкальциемии положительно коррелировала с объемом введенных масляных растворов, высоким уровнем экспрессии рецепторов к цитокину ИЛ-2 и гиперкальциурией. Авторы отмечают, что кроме избытка кальцитриола существуют другие причины гиперкальциемии, так как в ряде случаев она не сопровождалась повышением уровня витамина D [16].
Таким образом, наиболее вероятной причиной синдрома гиперкальциемии, снижения скорости клубочковой фильтрации, мочекаменной болезни являются внутримышечные инъекции синтола, сопровождающиеся формированием гранулем.
Для подтверждения выдвинутой гипотезы о гиперкальциемии, ассоциированной с гранулематозными заболеваниями, проведено исследование метаболитов витамина D. Ожидалось, что будет получен высокий уровень 1,25(ОН)2D3 и потенциально снижение соотношения 25(ОН)D3/24,25(OH)2D3. Тем не менее получены низкие значения уровня 1,25(ОН)2D3 и высокое соотношение 25(ОН)D3/24,25(OH)2D3. Снижение кальцитриола (1,25(ОН)2D3) с одной стороны обусловлено снижением почечной функции и снижением 1-α гидроксилазы, с другой — пониженным уровнем ПТГ, который стимулирует выработку той же 1-α гидроксилазы. 24-гидроксилаза обеспечивает эффективное преобразование 25-гидроксихолекальциферола (25(OH)D3) в 24,25-(OH)2D3 в качестве альтернативы синтезу 1,25-дигидроксихолекальциферола (1,25‐(OH)2D3) — активного метаболита витамина D (кальцитриола). Содействие метаболизму 25(ОН)D3 в 24,25(ОН)2D3 способствует уменьшению запасов 25(ОН)D3, что приводит к ускоренному клиренсу кальцитриола. В данном случае, скорее всего, имеет место нарушение нескольких звеньев метаболизма витамина D, истощение его запасов и, как следствие, повышение соотношения 25-ОН-D3/24,25(ОН)2D3. Другой причиной повышения соотношения 25(ОН)D3/24,25(OH)2D3 может являться нарушение инактивации активных метаболитов витамина D и, как следствие, низкий уровень 24,25(ОН)2D3. Основными причинами нарушения метаболизма у нашего пациента могут быть выраженная ХБП при сниженном ПТГ за счет гиперкальциемии.
В настоящее время специфическое лечение не разработано, однако у большинства пациентов с гиперкальциемией после введения масляных растворов эффективна терапия преднизолоном (терапевтическая доза 25–50 мг в сутки), направленная на подавление активности 1α-гидроксилазы [5][9]. Максимальная длительность лечения составила 6 месяцев, но данные о состоянии фосфорно-кальциевого обмена на фоне отмены преднизолона отсутствуют [5]. Потенциально возможно использование бисфосфонатов, деносумаба, ингибиторов JAK-киназ как наиболее специфичных ингибиторов продукции 1,25(OH)2D3 [19].
Также в литературе описаны случаи хирургического лечения [6][8][9][22], цель которого заключается в ограничении миграции синтола вглубь мягких тканей. В качестве метода визуализации предпочтительно использовать Т1- и Т2-взвешенные изображения магнитно-резонансной томографии (МРТ), а также МРТ с контрастом (гадолинием) [7][22]. Также возможно проведение УЗИ для выявления поверхностно расположенного повреждения [6]. На активной стадии процесса хирургическое вмешательство может включать удаление кист с масляными растворами, иссечение поврежденных тканей и гранулем [5][6][8][21]. Однако при переходе процесса в хроническую стадию и развитии выраженного фиброза (как в представленном нами случае) удаления всего объема поврежденных тканей сопряжено с высоким риском инвалидизации пациента [6][8][18].
В представленном нами случае на первый план выходит устранение интенсивного болевого синдрома и снижение лекарственной нагрузки, поскольку прием НПВП усугубляет снижение скорости клубочковой фильтрации (ХБП С3б, СКФ по данным пробы Реберга 42 мл/мин), и, таким образом, затрудняет коррекцию нарушения обмена кальция.
ЗАКЛЮЧЕНИЕ
Образование гранулем на фоне внутримышечных инъекций масляных растворов (синтол) относится к малоизученным нарушениям фосфорно-кальциевого обмена, которое может привести к тяжелым последствиям в виде гиперкальциемии, развитию ХБП, нефролитиаза и нефрокальциноза. Необходимо проведение дальнейших исследований с целью уточнения патогенетических причин синдрома гиперкальциемии, разработки оптимальных алгоритмов диагностики и тактики лечения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Рунова Г.Е. — концепция и дизайн исследования, сбор и анализ полученных данных, написание текста; Пешева Е.Д. — сбор и обработка материалов, написание текста; Вастистова А.А. — написание текста статьи, сбор, анализ литературы; Рожинская Л.Я. — концепция исследования, анализ полученных данных и редакция текста; Полубояринова И.В. — анализ данных и написание текста; Васильева М.П. — анализ данных и написание текста; Гурова О.Ю. — анализ данных и написание текста; Фадеев В.В. — концепция и дизайн исследования.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Остеопороз и остеопатии».
Благодарности. Авторы выражают благодарность сотрудникам эндокринологического терапевтического отделения №1 УКБ №2 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет) за помощь в подготовке данного клинического случая.
Список литературы
1. Marcocci C. and Cetani F. Primary hyperparathyroidism. The New England Journal of Medicine. Vol. 365, no. 25, pp. 2389-2397, 201; doi: https://doi.org/10.1056/NEJMcp1106636
2. Fisken RA, Heath DA, Bold AM. Hypercalcaemia — a hospital survey. Q J Med. 1980;49:405-418
3. Thomas P. Jacobs, Martin Kaufman, Glenville Jones, et al. A Lifetime of Hypercalcemia and Hypercalciuria. Finally Explained Clinical Endocrinology and Metabolism. March 2014, 99(3):708-712 doi: https://doi.org/10.1210/jc.2013-3802
4. Рожинская Л.Я., Пушкарева А.С., Мамедова Е.О. и соавт. Паратгормон-независимая гиперкальциемия и гиперкальциурия у пациента с нефролитиазом и нефрокальцинозом, обусловленные нарушением метаболизма витамина D вследствие дефекта гена CYP24A1 // Остеопороз и остеопатии. 2021; 24(1):26-33. doi: https://doi.org/10.14341/osteo12920
5. Anne Sophie KoldkjarS0lling et al. Non-parathyroid hypercalcemia associated with paraffin oil injection in 12 younger male bodybuilders: a case series. Eur J Endocrinol. 2018 Jun;178(6):K29-K37; doi: https://doi.org/10.1530/EJE-18-0051
6. Andrea Sisti et al. Oil injection for cosmetic enhancement of the upper extremities: a case report and review of literature. J Acta Biomed. 2020; 91(3):e2020082; doi: https://doi.org/10.23750/abm.v91i3.8533
7. Banke IJ, Prodinger PM, Waldt S, et al. Irreversible muscle damage in bodybuilding due to long-term intramuscular oil injection. International journal of sports medicine. 2012;33:829-34. doi: https://doi.org/10.1055/s-0032-1311582
8. Hamm C, Azad S. Delayed oleoma formation with injection of oil-suspended testosterone: A case report and review of pathogenesis. SAGE Open Medical Case Reports. 2022;10; doi: https://doi.org/10.1177/2050313X221086318
9. Di Benedetto G, Pierangeli M, Scalise A. Bertani A. Paraffin oil injection in the body: an obsolete and destructive procedure. Ann Plast Surg. 2002;49:391-6.; doi: https://doi.org/10.1097/00000637-200210000-00010
10. Laitano FF, Gazzale A, Siqueira EJ, et al. Complicates de autoinjejao de agentes quimicos para aumento muscular. Rev Bras Cir Plast. 2016:31; doi: https://doi.org/10.5935/2177-1235.2016RBCP0022
11. Moraitis AG, Hewison M, Collins M, et al. Hypercalcemia associated with mineral oil-induced sclerosing paraffinomas. Endocr Pract. 2013;19(2):e50-6; doi: https://doi.org/10.4158/EP12092.CR
12. Munchow H. Paraffin-oil damage to tissue as in the example of calcified paraffinomas in mammae. Radiol Diagn. 1966;7(6):743-7
13. Georgieva J, Assaf C, Steinhoff M, et al. Bodybuilder oleoma. The British Journal Of Dermatology. 2003;149:1289-90; doi: https://doi.org/10.1111/j.1365-2133.2003.05742.x
14. Iversen L, Lemcke A, Bitsch M, Karlsmark T. Compression bandage as treatment for ulcers induced by intramuscular self-injection of paraffin oil. Acta Dermato-venereologica. 2009;89:196-7; doi: https://doi.org/10.2340/00015555-0583
15. Koopman M, Richter C, Parren RJ, Janssen M. Bodybuilding, sesame oil and vasculitis. Rheumatology. 2005;44:1135; doi: https://doi.org/10.1093/rheumatology/keh712
16. Gyldenlove M, Rorvig S, Skov L, Hansen D. Severe hypercalcaemia, nephrocalcinosis, and multiple paraffinomas caused by paraffin oil injections in a young bodybuilder. Lancet. 2014;383(9934):2098; doi: https://doi.org/10.1016/S0140-6736(14)60806-0
17. Hall M, Grogan S, Gough B. Bodybuilders' accounts of synthol use: The construction of lay expertise online. Journal of health psychology. 2016;21:1939-48; doi: https://doi.org/10.1177/1359105314568579
18. Henriksen TF, Lovenwald JB, Matzen SH. Paraffin oil injection in bodybuilders calls for preventive action. Ugeskrift For Laeger. 2010;172:219-20
19. Ebbe Eldrup, 1 Simone Theilade et al. Hypercalcemia After Cosmetic Oil Injections: Unraveling Etiology, Pathogenesis, and Severity. Journal of Boneand Mineral Research. 2021
20. Jonathan Zagzag, MD, MPH1 et al. Hypercalcemia and Cancer: Differential Diagnosisand Treatment. CACancer J Clin. 2018 Sep;68(5):377-386; doi: https://doi.org/10.3322/caac.21489
21. Trivalle C, Profit P, Bonnet B, et al. Liver lipogranulomas with longterm fever caused by paraffin oil. Gastroenterol Clin Biol. 1991;15 (6-7):551-3
22. Schafer CN, Hvolris J, Karlsmark T, Plambech M. Muscle enhancement using intramuscular injections of oil in bodybuilding: review on epidemiology, complications, clinical evaluation and treatment. European Surgery: ACA Acta Chirurgica Austriaca. 2012;44:109-15; doi: https://doi.org/10.1007/s10353-011-0033-z
Об авторах
Г. Е. РуноваРоссия
Рунова Гюзель Евгеньевна - к.м.н., доцент кафедры.
Москва
Конфликт интересов:
Нет
Е. Д. Пешева
Россия
Пешева Екатерина Дмитриевна - ассистент кафедры.
Москва
Конфликт интересов:
Нет
А. А. Вастистова
Россия
Вастистова Анастасия Алексеевна - клинический ординатор.
119435, Москва, ул. Погодинская, д. 1с1
Конфликт интересов:
Нет
Л. Я. Рожинская
Россия
Рожинская Людмила Яковлевна - д.м.н., профессор.
Москва
Конфликт интересов:
Нет
И. В. Полубояринова
Россия
Полубояринова Ирина Владимировна - к.м.н., доцент кафедры.
Москва
Researcher ID: AAL-6684-2021
Конфликт интересов:
Нет
М. П. Василевская
Россия
Василевская Мария Павловна - к.м.н., заместитель главного врача по медицинской части УКБ №3, врач-нефролог.
Москва
Конфликт интересов:
Нет
О. Ю. Гурова
Россия
Гурова Олеся Юрьевна - к.м.н., доцент кафедры.
Москва
Конфликт интересов:
Нет
В. В. Фадеев
Россия
Фадеев Валентин Викторович - д.м.н., профессор, член-корреспондент РАН.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Места инъекций масляных растворов. | |
| Тема | ||
| Тип | Данные | |
Посмотреть
(178KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Рунова Г.Е., Пешева Е.Д., Вастистова А.А., Рожинская Л.Я., Полубояринова И.В., Василевская М.П., Гурова О.Ю., Фадеев В.В. Гиперкальциемия с развитием хронической болезни почек, нефролитиаза после введения масляных растворов в мышцы. Остеопороз и остеопатии. 2023;26(3):33-39. https://doi.org/10.14341/osteo13141
For citation:
Runova G.E., Pesheva E.D., Vastistova A.A., Rozhinskaya L.Ya., Poluboyarinova I.V., Vasilevskaya M.P., Gurova O.Yu., Fadeev V.V. Hypercalcemia with the development of chronic kidney disease, nephrolithiasis after intramuscular injection of oil solutions. Osteoporosis and Bone Diseases. 2023;26(3):33-39. (In Russ.) https://doi.org/10.14341/osteo13141

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































