Перейти к:
Современные представления о механизме действия бисфосфонатов. Влияние длительного приема бисфосфонатов на костную ткань (доклинические исследования)
https://doi.org/10.14341/osteo13147
Аннотация
Остеопороз (ОП) — одно из наиболее распространенных хронических заболеваний у лиц пожилого возраста, которое требует продолжительной терапии. Бисфосфонаты (БФ) относятся к препаратам первого выбора для лечения ОП, однако в ходе длительного применения этих препаратов выявлена связь между ними и такими патологическими состояниями, как атипичные переломы бедра, медикаментозный остеонекроз челюсти (МОНЧ), а также рассматриваются вопросы возможного их влияния на процессы консолидации переломов, что привлекает повышенное внимание к текущему широкому их использованию.
В статье представлены существующие классы БФ, различия в их строении и антирезорбтивной активности. Рассматриваются вопросы механизма действия простых и азотсодержащих БФ на кость, а также данные исследований на животных моделях по их влиянию на механические свойства кости, консолидацию переломов, а также развитию МОНЧ.
Ключевые слова
Для цитирования:
Торопцова Н.В., Баранова И.А. Современные представления о механизме действия бисфосфонатов. Влияние длительного приема бисфосфонатов на костную ткань (доклинические исследования). Остеопороз и остеопатии. 2023;26(3):4-11. https://doi.org/10.14341/osteo13147
For citation:
Toroptsova N.V., Baranova I.A. Current vision on mechanism of action of bisphosphonates. The effect of long-term administration of bisphosphonates on bone tissue (preclinical studies). Osteoporosis and Bone Diseases. 2023;26(3):4-11. (In Russ.) https://doi.org/10.14341/osteo13147
С момента своего появления в клинической практике более пяти десятилетий назад бисфосфонаты (БФ) все чаще используются для лечения целого ряда заболеваний, таких как наследственные заболевания скелета у детей и взрослых, постменопаузальный и глюкокортикоидный остеопороз (ГКОП), метастазы в кости у пациентов со злокачественными новообразованиями, костная болезнь Педжета, множественная миелома. Однако в ходе длительного применения этих препаратов выявлена связь между ними и такими патологическими состояниями, как атипичные переломы бедренной кости, медикаментозный остеонекроз челюсти (МОНЧ), а также рассматриваются вопросы возможного их влияния на процессы консолидации переломов, вследствие низкого костного обмена, что привлекает повышенное внимание к текущему широкому использованию БФ.
СТРОЕНИЕ И МЕХАНИЗМ ДЕЙСТВИЯ БФ
Структурно БФ являются химически стабильными производными неорганического пирофосфата (НПФ), природного соединения, в котором две фосфатные группы связаны с центральным негидролизуемым углеродом (рис. 1). В организме человека НПФ высвобождается как побочный продукт многочисленных метаболических реакций и его можно легко обнаружить во многих тканях, включая кровь и мочу [1]. Новаторские исследования, проведенные в 1960-х годах, показали, что НПФ способен ингибировать кальцификацию путем связывания с кристаллами гидроксиапатита, что привело к гипотезе о том, что регуляция уровня НПФ может быть механизмом, с помощью которого регулируется минерализация костей [2].
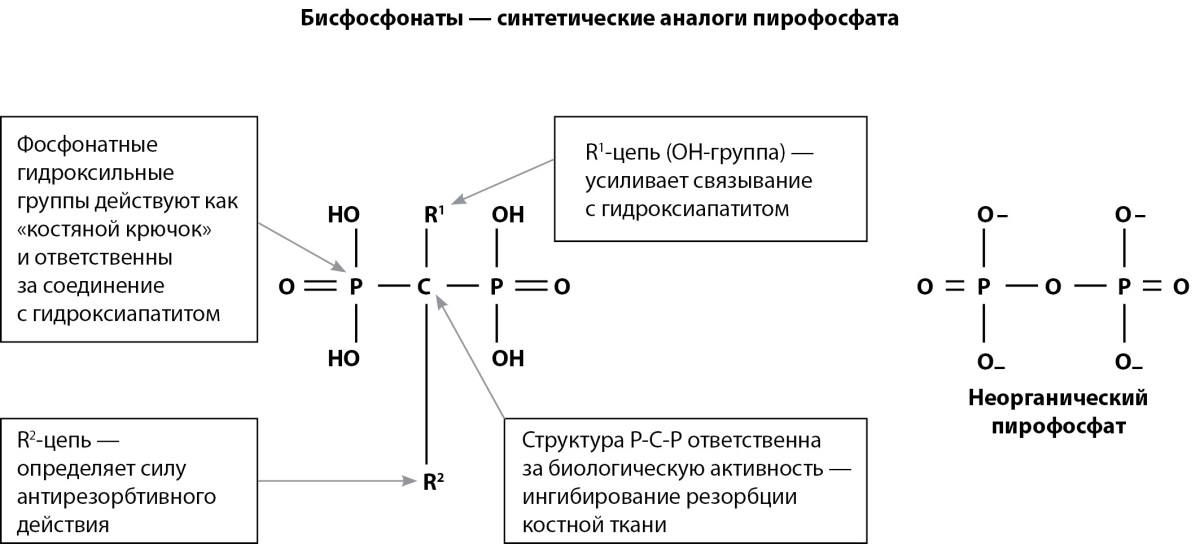
Рисунок 1. Строение неорганического пирофосфата и БФ.
БФ обладают очень высоким сродством к костному минералу, поскольку они связываются с кристаллами гидроксиапатита. Они преимущественно включаются в участки активного ремоделирования кости, что обычно происходит в условиях, характеризующихся ускоренным обновлением скелета. БФ, не поглощенные костной тканью в скелете быстро выводятся, быстро выводится из кровообращения путем почечной экскреции. Помимо способности ингибировать кальцификацию, БФ ингибируют распад гидроксиапатита, тем самым эффективно подавляя резорбцию костной ткани [3]. Это фундаментальное свойство БФ привело к их клиническому использованию. Также было высказано предположение, что БФ также ограничивают апоптоз остеобластов и остеоцитов [4][5]. Относительная важность этой функции для активности БФ в настоящее время не ясна [6].
Модификация химической структуры БФ увеличила различия между их эффективными концентрациями, необходимыми для антирезорбтивной активности, по сравнению с концентрациями, подавляющими минерализацию костного матрикса, делая циркулирующие концентрации всех БФ, используемых в настоящее время в клинической практике, активными, по существу, только для подавления скелетной резорбции. В отличие от НПФ, почти все БФ также имеют гидроксильную группу, присоединенную к центральному углероду (R¹ боковая цепь), которая еще больше увеличивает способность БФ связывать кальций (рис. 1). В совокупности фосфатные и гидроксильные группы создают третичное, а не бинарное взаимодействие между БФ и костным матриксом, придавая этим препаратам их важную специфичность для кости [1].
Хотя фосфатные и гидроксильные группы необходимы для прикрепления БФ к костному матриксу, R² боковая цепь, связанная с центральным атомом углерода, является основным фактором, определяющим активность БФ для подавления резорбции кости.
БФ обнаруживаются в печени после перорального и парентерального введения, но эти лекарственные средства обычно не подвергаются в ней метаболизму. Важнейшей фармакологической особенностью всех БФ является их чрезвычайно высокое сродство к костной ткани. Это позволяет БФ достигать высокой локальной концентрации по всему скелету. Соответственно, БФ стали основной терапией скелетных заболеваний, характеризующихся чрезмерным или несбалансированным ремоделированием костной ткани с преобладанием остеокласт-опосредованной резорбции кости. Некоторое количество БФ высвобождается в кровоток во время резорбции из кости, а некоторое — после апоптоза и гибели остеокластов, хотя нет данных о фактическом вкладе любого из этих процессов в долгосрочное выведение их с мочой. БФ, высвобождаемые из кости, могут подвергаться повторному поглощению на ее поверхности, процесс, который может зависеть от их относительного сродства к костному минералу. БФ обнаруживаются в моче в течение многих лет после прекращения лечения [7]. Период полувыведения для них может составлять от 1 до 10 лет.
Простые (неазотсодержащие) БФ (этидронат, клодронат и тилудронат) считаются препаратами первого поколения. Из-за их близкого структурного сходства с НПФ они включаются в молекулы новообразованного аденозинтрифосфата (АТФ) с помощью аминоацил-трансферной РНК-синтетаз класса II после поглощения остеокластами с поверхности костного минерала [1]. Считается, что внутриклеточное накопление этих негидролизуемых аналогов АТФ (AppCp) является цитотоксическим для остеокластов, поскольку они ингибируют множественные АТФ-зависимые клеточные процессы, что приводит к апоптозу этих клеток.
В отличие от первых препаратов, БФ второго и третьего поколений содержат атом азота в R² боковой цепи (рис. 2). Присутствие азота или аминогруппы увеличивает антирезорбтивную активность БФ в 100–10 000 раз по сравнению с этидронатом — первым простым БФ [8]. Так, антирезорбтивный потенциал у алендроната превосходит в 500 раз, а золедроновой кислоты — в 10 000 раз активность этидроната.
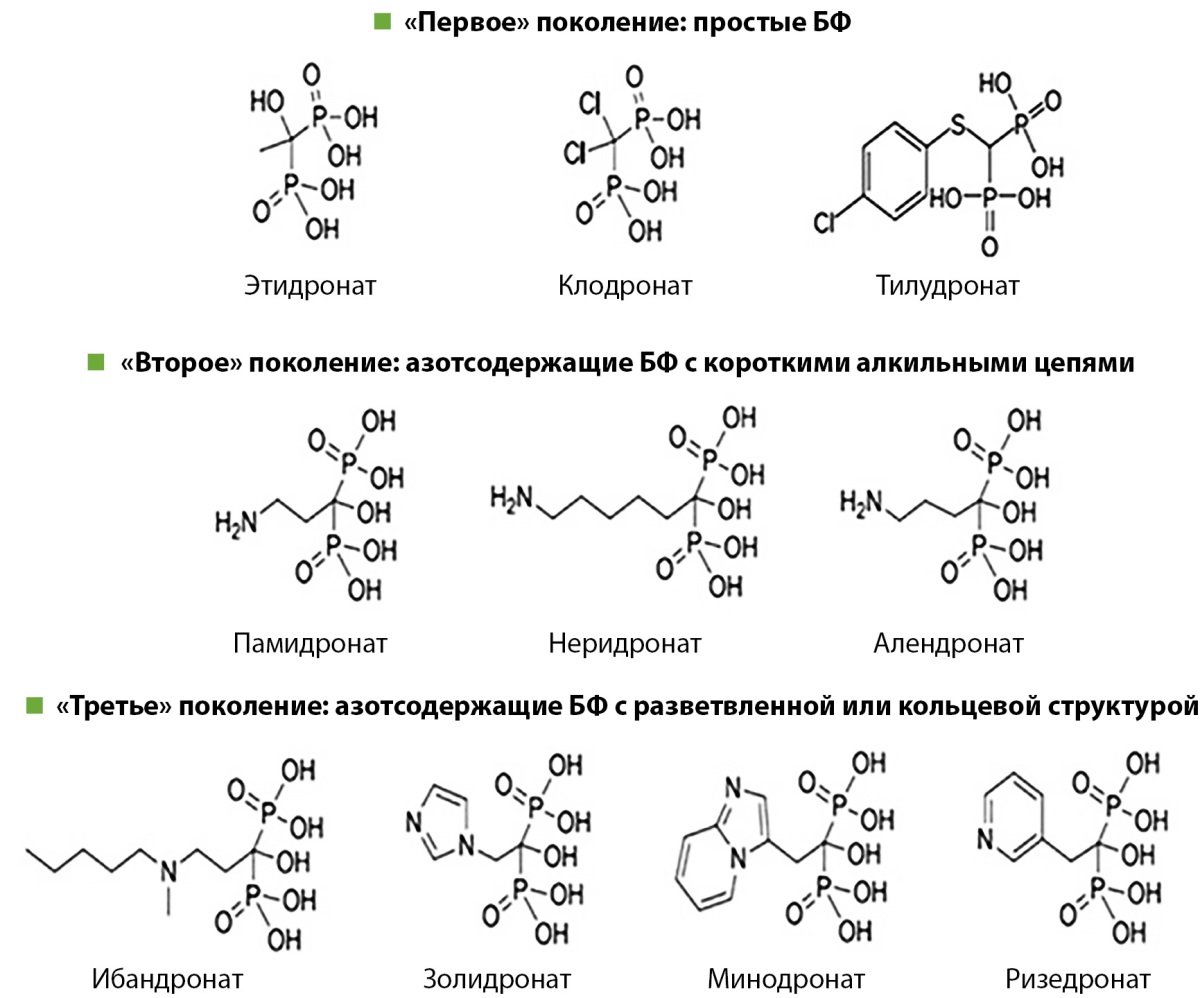
Рисунок 2. Строение бисфосфонатов.
Механизм, с помощью которого азотсодержащие БФ способствуют апоптозу остеокластов, отличается от механизма действия простых БФ. Так, азотсодержащие БФ ингибируют активность фарнезилпирофосфат (ФПФ) синтазы, ключевого регуляторного фермента в пути превращения мевалоновой кислоты, имеющей решающее значение для производства холестерина, других стеаринов и изопреноидных липидов (рис. 3). Это приводит к потере длинноцепочечных изопреноидных липидов, требующихся для пренилирования G-белков (Ras, Rho Rab и др.), являющихся сигнальными белками, необходимыми для выживания и активности остеокластов [8][9]. Пренилированные малые ГТФазы семейств Ras, Rho, Rac, Cdc42 и Rab регулируют в остеокластах различные клеточные процессы, необходимые для резорбции кости, включая расположение цитоскелета, формирование гофрированной мембраны, транспортировку внутриклеточных везикул и апоптоз [10].
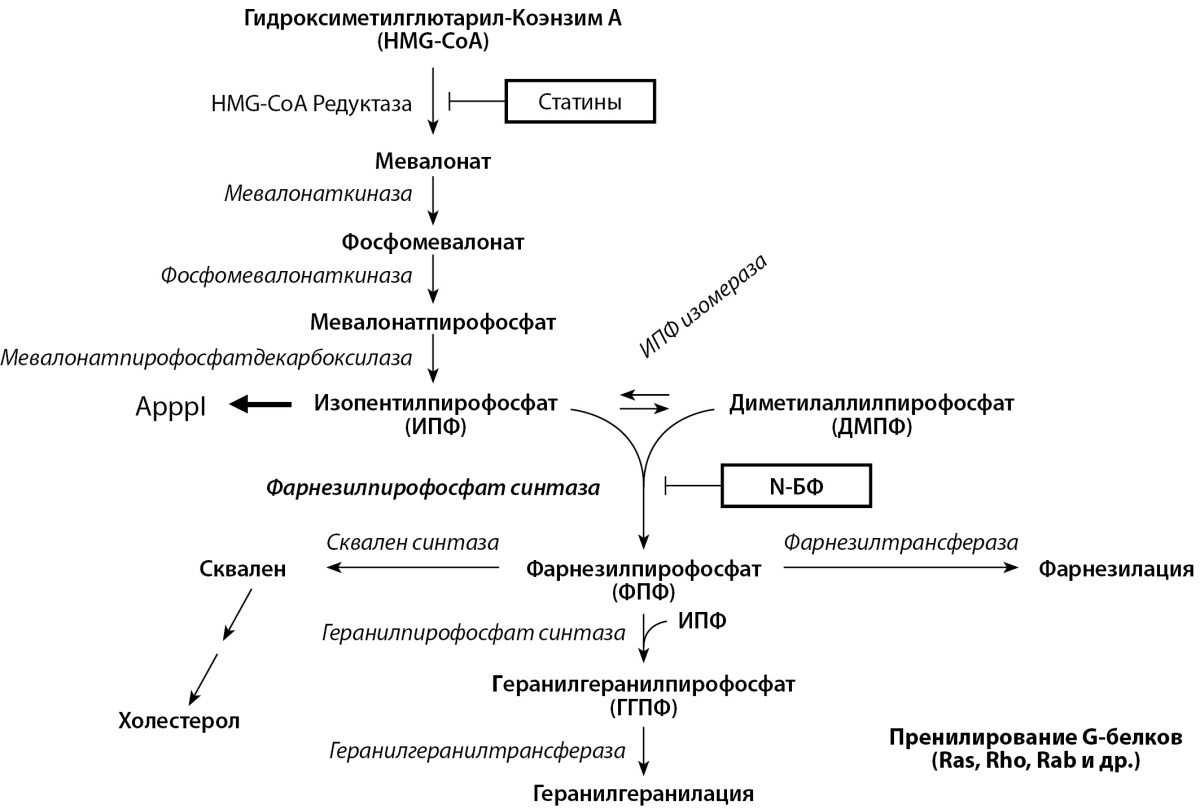
Рисунок 3. Влияние азотсодержащих бисфосфонатов
на мевалонатный путь синтеза холестерина.
Помимо предотвращения пренилирования белков, азотсодержащие БФ, индуцируя ингибирование ФПФ-синтазы, приводят к образованию нового эндогенного аналога АТФ (ApppI), который подавляет митохондриальную транслоказу адениновых нуклеотидов, вызывая апоптоз остеокластов. В то же время ApppI, в отличие от AppCp простых БФ, не содержит их в своей структуре [11].
Однако, в отличие от простых БФ, антирезорбтивный эффект азотсодержащих БФ не полностью зависит от гибели остеокластов. Halasy-Nagy et al. показали, что предотвращение апоптоза остеокластов in vitro с помощью ингибитора каспазы не влияло на их способность блокировать резорбцию костной ткани, как это было в случае с простыми БФ [12]. В другой работе, проведенной на модели остеогенных клеток, которые не содержат минерализованного матрикса или остеокласты, было продемонстрировано влияние БФ на предшественников остеокластов в премитотической стадии. Результаты показали, что азотсодержащие БФ могут подавлять остеокластическую резорбцию in vitro путем прямого воздействия на очень ранние предшественники остеокластов на поверхности кости, а не путем влияния на остеокластогенную способность остеогенных клеток. Механизм действия азотсодержащих БФ включает ингибирование геранилгеранилирования белка, что указывает на молекулярный механизм, аналогичный установленному для зрелых остеокластов [13].
Кроме того, получены данные, что азотсодержащие бисфосфонаты также могут подавлять, хотя и менее мощно, другие ферменты в мевалонатном пути, включая изопентенилдифосфат (ИПФ) изомеразу и геранилгеранилдифосфат (ГГПФ) синтазу [14][15], а также скваленсинтазу [16].
Таким образом, основной фармакологический эффект БФ заключается в снижении скорости костного ремоделирования с замедлением, в первую очередь костной резорбции, обусловленное нарушением функции и апоптозом остеокластов.
ИССЛЕДОВАНИЯ НА МОДЕЛЯХ ЖИВОТНЫХ
Влияние длительного приема БФ на механические свойства кости
В связи с отсутствием внутрикортикального ремоделирования исследования у грызунов не могут отражать таковые процессы у людей [17]. Исследования на моделях крупных животных (собаках, овцах, приматах) не дали ясного представления об изменении механических свойств кости на фоне введения БФ — результаты различаются в зависимости от вида животных, участка скелета, продолжительности лечения, оцениваемых механических параметров, способа тестирования и пр. [17]. Так, по данным Balena c соавт., длительное введение алендроната собакам в дозе, в 5 раз превышающей таковую для лечения ОП в клинических исследованиях, не влияло на объем кортикальной или губчатой кости и показатели костной архитектуры. Толщина остеоида и время минерализации не изменились в результате лечения. Таким образом, применение БФ не вызывало нарушений ремоделирования или структуры кости [18].
Дальнейшие исследования на собаках с использованием ризедроната или алендроната перорально в высоких дозах (в 6 раз превышающих клинические дозы для лечения остеопороза у людей) в течение года показали подавление ремоделирования в интракортикальных отделах ребер и трабекулярной ткани позвонка и подвздошной кости без нарушения минерализации, а также повышенное накопление микроповреждений, что приводило к снижению некоторых механических свойств кости. По мнению авторов этой работы, исследование имело ряд недостатков: не доказана прямая причинно-следственной связь низкого обмена костной ткани с накоплением микроповреждений (это можно было доказать, если увеличение костного обмена приводило к уменьшению накопления микроповреждений); дозы бисфосфонатов, использованные в этом эксперименте, были в 6 раз выше рекомендуемой клинической дозы. Таким образом, полученные результаты не могут быть перенесены на клиническую ситуацию [19][20]. В более поздних работах было показано, что накопление микроповреждений в ребрах и позвонках наблюдается в основном на более высоких дозах, чем клинические [21][22]. По данным исследования Allen M.R. и Burr D.B., количество микроповреждений в позвонках через три года лечения незначительно увеличивалось по сравнению с первым годом лечения, что свидетельствовало о том, что микроповреждения появляются в начале терапии. Поскольку прочность продолжала уменьшаться в течение 3 лет применения алендроната в высокой дозе, авторы сделали вывод о том, что снижение прочности не зависит от накопления повреждений [22].
В то же время изучение внутренних механических свойств диафиза бедренной кости собак, получавших в течение года или 3 лет алендронат в различных дозах, не выявил каких-либо отличий в механической прочности от контрольной группы [23].
Bajaj D. с соавт. проведены испытания костных балок, выточенных из кортикальной ткани ребер собаки, на циклическую нагрузку. Этот участок скелета имеет высокий костный обмен (~20% в год), который, как было показано, значительно замедляется после 3-летнего лечения алендронатом в клинически значимых дозах. Механические свойства кортикальной кости изучались при простой монотонной квазистатической нагрузке. Повреждения и микроархитектурные характеристики зависели от дозы алендроната в течение 3 лет. Снижение модуля упругости (начальные циклы нагрузки) и усталостного ресурса (количества циклов до разрушения) наблюдалось при самой высокой дозе алендроната. Не влияя на количество остеонов, лечение алендронатом уменьшало другие характеристики, связанные с ремоделированием кости, такие как размер остеонов и плотность лакун остеоцитов. При этом плотность лакун остеоцитов была прямо пропорциональна исходному модулю упругости. Эти данные свидетельствуют о том, что структурные компоненты, которые обычно способствуют здоровью кортикальной костной ткани, изменяются под воздействием высоких доз алендроната, что способствует снижению механических свойств в условиях циклической нагрузки [24]. Главным достижением этой работы явилось то, что авторы пытались смоделировать разрушение кости в более реалистичной ситуации. Исследования на усталость позволяют оценить разрушение кости с течением времени под воздействием субповреждающих нагрузок, особенно в условиях, когда активность ремоделирования значительно подавлена, и получить данные о том, как лекарства влияют на функциональные свойства костей [17].
Другое исследование оценивало кортикальные костные балки из плечевых костей собак. Животным назначали алендронат в течение 3 лет в клинически значимой дозе. Были исследованы механизмы прочности с помощью современных экспериментов с синхротронным рентгеновским излучением. Монотонные испытания и испытания на растяжение показали снижение свойств кости у животных, получавших алендронат, по сравнению с контрольной группой, хотя только некоторые параметры достигли статистической значимости. Испытания на прочность к переломам не выявили различий между контрольной группой и группой БФ по возникновению трещин и их увеличению. Тесты на растяжение показали, что две группы имели одинаковые реакции на стресс/растяжение тканей при небольших нагрузках, тогда как при более высоких нагрузках наблюдались значительные изменения в костях животных, получавших алендронат. Учитывая это, авторы пришли к выводу, что повреждение коллагена, а не минерального состава кости могли вызвать такие изменения. По данным исследования, применение БФ может увеличить неферментативное сшивание коллагена на молекулярном уровне, что ограничивает пластичность, связанную со скольжением фибрилл, и влияет на прочность кости. Также изменялась архитектоника кости: наблюдалось уменьшение плотности и диаметра Гаверсовых каналов, количества остеонов, увеличение накопления и рост микротрещин, что потенциально может повышать предрасположенность кортикального слоя кости к атипичным (усталостным) переломам [25].
Влияние на сращение переломов
Учитывая, что БФ замедляют резорбцию кости — важный этап заживления переломов, этот класс соединений широко изучался в доклинических моделях на предмет их влияния на консолидацию переломов. Использовались несколько животных моделей, включая модели на мышах, крысах, кроликах, собаках и овцах. По данным исследований, использование БФ, в том числе при длительном применении, приводило к увеличению размера костной мозоли, что совпадало с задержкой ее ремоделирования — от первичной незрелой кости до зрелой ламеллярной (пластинчатой) кости, но не влияло на время заживление перелома и не снижало или даже повышало механические свойства образовавшейся мозоли [26–29].
В исследовании с применением как высоких, так и низких доз ризедроната у крыс со стрессовым переломом лучевой кости было показано, что только высокие дозы (в 2 раза превышающие терапевтические) приводили к снижению процента сросшихся переломов за счет уменьшения объема резорбированной и вновь образованной кости во время процесса ремоделирования. Обе дозы ризедроната не влияли на этапы формирования костной ткани и консолидации при заживлении стрессовых переломов [30]. На модели перелома у крыс Amanat c соавт. обнаружили, что прочность мозоли была выше, если золедроновая кислота вводилась через 1–2 недели после перелома, а не в течение первой недели [31]. Поскольку однократное применение азотсодержащего БФ приводит к образованию более прочной первичной костной мозоли со способностью к дальнейшему ремоделированию, Begkas D. с соавт. высказали мнение о целесообразности уменьшения частоты введения терапевтических доз, чтобы свести к минимуму их влияние на ремоделирование твердой мозоли [29]. Для разработки оптимальных дозировок и внедрения этой концепции в клиническую практику потребуются дальнейшие исследования.
Почки и костное ремоделирование
Большой интерес представляют процессы ремоделирования костной ткани на фоне хронической болезни почек (ХБП), которая может протекать с высоким и низким уровнем костного обмена. Ремоделирование кости оценивается у животных почти так же, как и у людей, с использованием флуоресцентных агентов, вводимых in vivo, с последующим гистологическим анализом. Гистологический анализ может дать множество параметров, но наиболее часто для определения скорости ремоделирования/обмена кости используется показатель скорости костеобразования (bone formation rate, BFR). Для участков трабекулярной кости эта переменная отражает образование кости в участках, которые, как предполагается, ранее подверглись резорбции в рамках стандартного связанного процесса ремоделирования (резорбция-формирование) [32]. В доклинических исследованиях на животных с ХБП 3–4 степени и признаками костных нарушений введение БФ приводило к изменениям качества костей, что улучшало их прочность. Обмен костной ткани снижался в одинаковой степени у животных с ХБП и без нее [33].
Клиническим примером высокого костного ремоделирования может быть вторичный гиперпаратиреоз. Используя модель ХБП с высоким уровнем костного обмена, Allen с соавт. показали, что при однократном внутрибрюшинном введении золедроновой кислоты (в двух разных дозах, в 5 раз отличающихся друг от друга) в течение 5 недель скорость трабекулярного костеобразования была значительно ниже, чем у нелеченых животных с ХБП и здоровых животных, но существенно не отличалась от здоровых животных, получавших золедронат [34]. Дальнейшие исследования с длительным наблюдением (до 10 недель) животных с ХБП после введения золедроновой кислоты определили значительное снижение скорости костеобразования по сравнению с такими же животными с ХБП, не получавшими золедроновую кислоту, однако показатели не отличались от нелеченых здоровых животных [33]. Таким образом, если при ХБП наблюдается высокая скорость трабекулярного костеобразования, БФ эффективно снижают ее до показателей, сравнимых для животных с нормальной функцией почек, получавших тот же препарат. И главное — отсутствуют признаки адинамической костной болезни, определяемой как полное подавление активности костных клеток [32].
При ХБП с низким ремоделированием экспериментальные данные ограничены. По результатам исследований БФ не приводили к адинамичной кости за счет подавления клеточной функции. Например, при использовании модели прогрессирующей ХБП, но на этот раз с добавками кальция (который снижает ПТГ и BFR в этой модели), наблюдалось умеренное дополнительное подавление BFR при добавлении лечения золедронатом, но она не отличалась от значений при применении у здоровых животных или животных с ХБП, получавших только кальций [35].
Таким образом, отсутствуют доказательства, что при ХБП концентрация БФ в скелете достигает токсических уровней, а подавление ремоделирования более выражено, чем у животных без ХБП.
Бисфосфонаты и остеонекроз челюсти
По данным обзора JI Aguirre с соавт., в настоящее время создано большое количество экспериментальных моделей для изучения остеонекроза челюсти, индуцированного приемом лекарственных средств. В доклинических исследованиях МОНЧ использовалось несколько видов животных, включая крысу, мышь, рисовую крысу, кролика, собаку, овцу и свинью. На экспериментальных моделях оценивались отдельные факторы риска и их сочетания, которые наблюдаются у людей, такие как экстракция зуба, воспалительные заболевания зубов (например, периодонтит, периапикальная инфекция), постановка имплантов, влияние сопутствующей терапии глюкокортикоидами и пр. [36]. Экспериментальные модели позволили определить патофизиологические механизмы развития этого осложнения при длительной терапии БФ, включающие изменения числа и функции костных клеток, роль воспалительного процесса, эпителия слизистых, кровоснабжения и т.д.
Однако, как и для других экспериментальных моделей для оценки длительных эффектов БФ, у животных моделей МОНЧ имеются определенные недостатки, которые определены следующими факторами:
- различия в строении мягких и твердых тканей человека и животных. Это особенно важно при исследованиях мелких грызунов, у которых кортикальная кость имеет ламеллярную структуру, а не Гаверсов канал, и не подвергается внутрикорковому ремоделированию, за исключением случаев, связанных с вмешательством. Потенциальные последствия таких структурных и физиологических различий в патофизиологии МОНЧ в настоящее время неясны;
- необходимость использования сверхвысоких доз антирезорбтивных средств для увеличения заболеваемости МОНЧ. Таким образом, всегда следует учитывать возможность нецелевых клеточных и молекулярных эффектов, которые могут не возникнуть в клинических условиях;
- схемы антирезорбтивного лечения, включая дозу, курс лечения, общую кумулятивную дозу, путь введения, наличие сопутствующей терапии (химиотерапия, антиангиогенные факторы, иммуномодуляторы и т.д.), продолжительность предварительного лечения до или лечения после применения местных провоцирующих факторов (т.е. удаление зубов, экспериментальное пародонтальное или периапикальное заболевание, установка имплантата и т.д.) значительно различаются в исследованиях на животных;
- нет единообразного использования критериев, определяющих наличие МОНЧ в моделях животных. Клинически или гистологически наличие обнажения кости используется во многих, но не во всех исследованиях. Часто наличие гистологически некротической кости является единственным параметром, указывающим на наличие МОНЧ. Простое присутствие гистологически некротической кости без признаков воздействия не соответствует клиническому диагнозу заболевания. Даже стадия 0 МОНЧ, при которой не наблюдается обнажения кости, характеризуется неспецифическими клиническими и/или рентгенологическими данными, а не только наличием участков кости с пустыми остеоцитарными лакунами;
- спользование удаления здоровых зубов в качестве местного провоцирующего фактора в большинстве исследований на животных, что, как описано ранее, не соответствует клинической реальности;
- технически сложная хирургическая процедура удаления зуба, особенно если целостность коронки нарушена, часто приводит к тому, что фрагменты корня остаются в лунках, что часто встречается в опубликованных отчетах. Такие фрагменты корня ставят под угрозу правильное заживление лунки в отсутствии или в присутствии антирезорбтивных средств и не отражают клиническую ситуацию. Животные с рентгенологическими или гистологическими доказательствами присутствия фрагментов корня должны быть исключены из анализа данных [37].
ЗАКЛЮЧЕНИЕ
Таким образом, основное патогенетическое действие БФ связано с подавлением резорбции кости как за счет потери функции, так и апоптоза остеокластов. Проведенные доклинические исследования продемонстрировали, что негативные данные по влиянию на костную ткань у животных получены только при использовании сверхвысоких доз БФ. Отсутствуют данные об возникновении адинамичной кости на фоне длительного приема БФ. Нет данных о том, что при ХБП концентрация БФ в скелете достигает токсических уровней, а подавление ремоделирования более выражено, чем у животных без ХБП. Лечение БФ не влияло на время заживления перелома и не снижало или даже повышало механические свойства образовавшейся мозоли. В то же время экспериментальные модели могут лишь косвенно отражать процессы в костной ткани, происходящие у человека.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Торопцова Н.В. — концепция, поиск литературы и написание текста; Баранова И.А. — концепция, поиск литературы и написание текста.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Russell RG. Bisphosphonates: from bench to bedside. Ann N Y Acad Sci. 2006;1068:367-401. doi: https://doi.org/10.1196/annals.1346.041
2. Fleisch H, Russell RG, Straumann F. Effect of pyrophosphate on hydroxyapatite and its implications in calcium homeostasis. Nature. 1966;212(5065):901-903. doi: https://doi.org/10.1038/212901a0
3. Russell RG, Muhlbauer RC, Bisaz S, et al. The influence of pyrophosphate, condensed phosphates, phosphonates and other phosphate compounds on the dissolution of hydroxyapatite in vitro and on bone resorption induced by parathyroid hormone in tissue culture and in thyroparathyroidectomised rats. Calcif Tissue. Res. 1970;6(3):183-196. doi: https://doi.org/10.1007/BF02196199
4. Plotkin LI, Aguirre JI, Kousteni S, et al. Bisphosphonates and estrogens inhibit osteocyte apoptosis via distinct molecular mechanisms downstream of extracellular signal-regulated kinase activation. J Biol Chem. 2005; 280:7317-7325. doi: https://doi.org/10.1074/jbc.M412817200
5. Bellido T, Plotkin LI. Novel actions of bisphosphonates in bone: preservation of osteoblast and osteocyte viability. Bone. 2011 Jul;49(1):50-5. doi: https://doi.org/0.1016/j.bone.2010.08.008
6. Rogers MJ, Monkkonen J, Munoz MA. Molecular mechanisms of action of bisphosphonates and new insights into their effects outside the skeleton. Bone. 2020, Volume 139, 115493. doi: https://doi.org/10.1016/j.bone.2020.115493
7. Papapoulos SE, Cremers SC. Prolonged bisphosphonate release after treatment in children. N Engl J Med. 2007;356(10):1075-1076. doi: https://doi.org/10.1056/NEJMc062792
8. Dunford JE, Thompson K, Coxon FP, et al. Structure-activity relationships for inhibition of farnesyl diphosphate synthase in vitro and inhibition of bone resorption in vivo by nitrogen-containing bisphosphonates. J Pharmacol Exp Ther. 2001;296(2):235-242
9. Kavanagh KL, Guo K, Dunford JE, et al. The molecular mechanism of nitrogen-containing bisphosphonates as antiosteoporosis drugs. Proc Natl Acad Sci U S A. 2006 May 16;103(20):7829-7834. doi: https://doi.org/10.1073/pnas.0601643103
10. Itzstein C, Coxon FP, Rogers MJ. The regulation of osteoclast function and bone resorption by small GTPases. Small GTPases. 2011;2 (3):117-130. doi: https://doi.org/10.4161/sgtp.2.3.16453
11. Monkkonen H, Auriola S, Lehenkari P, et al. A new endogenous ATP analog (ApppI) inhibits the mitochondrial adenine nucleotide translocase (ANT) and is responsible for the apoptosis induced by nitrogen-containing bisphosphonates. Br J Pharmacol. 2006;147(4):437-45. doi: https://doi.org/10.1038/sj.bjp.0706628
12. Halasy-Nagy JM, Rodan GA, Reszka AA. Inhibition of bone resorption by alendronate and risedronate does not require osteoclast apoptosis. Bone. 2001;29(6):553-559. doi: https://doi.org/10.1016/s8756-3282(01)00615-9
13. Van Beek ER, Lowik CWGM, Papapoulos SE. Bisphosphonates suppress bone resorption by a direct effect on early osteoclast precursors without affecting the osteoclastogenic capacity of osteogenic cells: the role of protein geranylgeranylation in the action of nitrogencontaining bisphosphonates on osteoclast precursors. Bone. 2002;30(1):64-70. doi: https://doi.org/10.1016/S8756-3282(01)00655-X
14. Thompson K, Dunford JE, Ebetino FH, Rogers MJ. Identification of a bisphosphonate that inhibits isopentenyl diphosphate isomerase and farnesyl diphosphate synthase. Biochem. Biophys. Res. Commun. 2002;290(2):869-873. doi: https://doi.org/10.1006/bbrc.2001.6289
15. Kavanagh KL, Dunford JE, Bunkoczi G, et al. The crystal structure of human geranylgeranyl pyrophosphate synthase reveals a novel hexameric arrangement and inhibitory product binding. J. Biol. Chem. 2006;281(31):22004-22012. doi: https://doi.org/10.1074/jbc.M602603200
16. Amin D, Cornell SA, Perrone M.H, Bilder G.E. 1-Hydroxy-3-(methylpentylamino)-propylidene-1,1-bisphosphonic acid as a potent inhibitor of squalene synthase. Arzneimittel-Forschung. 1996;46(8):759-762
17. Allen MR. Recent Advances in Understanding Bisphosphonate Effects on Bone Mechanical Properties. Curr Osteoporos Rep. Apr 2018;16(2):198-204. doi: https://doi.org/10.1007/s11914-018-0430-3
18. Balena R, Markatos A, Seedor JG, et al. Long-term safety of the aminobisphosphonate alendronate in adult dogs. II. Histomorphometric analysis of the L5 vertebrae. J Pharmacol Exp Ther. Jan 1996;276(1):277-83
19. Mashiba T, Turner CH, Hirano T, et al. Effects of suppressed bone turnover by bisphosphonates on microdamage accumulation and biomechanical properties in clinically relevant skeletal sites in beagles. Bone. May 2001;28(5):524-31. doi: https://doi.org/10.1016/s8756-3282(01)00414-8
20. Mashiba T, Hirano T, Turner CH, et al. Suppressed bone turnover by bisphosphonates increases microdamage accumulation and reduces some biomechanical properties in dog rib. J Bone Miner Res. Apr 2000;15(4):613-20. doi: https://doi.org/10.1359/jbmr.2000.15.4.613
21. Allen MR, Reinwald S, Burr DB. Alendronate reduces bone toughness of ribs without significantly increasing microdamage accumulation in dogs following 3 years of daily treatment. Calcif Tissue Int. May 2008;82(5):354-60. doi: https://doi.org/10.1007/s00223-008-9131-8
22. Allen MR, Burr DB. Three years of alendronate treatment results in similar levels of vertebral microdamage as after one year of treatment. J Bone Miner Res. Nov 2007;22(11):1759-65. doi: https://doi.org/10.1359/jbmr.070720
23. Burr DB, Diab T, Koivunemi A, et al. Effects of 1 to 3 years' treatment with alendronate on mechanical properties of the femoral shaft in a canine model: implications for subtrochanteric femoral fracture risk. J Orthop Res. Oct 2009;27(10):1288-92. doi: https://doi.org/10.1002/jor.20895
24. Bajaj D, Geissler JR, Allen MR, et al. The resistance of cortical bone tissue to failure under cyclic loading is reduced with alendronate. Bone. Jul 2014;64:57-64. doi: https://doi.org/10.1016/j.bone.2014.03.045
25. Acevedo C, Bale H, Gludovatz B, et al. Alendronate treatment alters bone tissues at multiple structural levels in healthy canine cortical bone. Bone. Dec 2015;81:352-363. doi: https://doi.org/10.1016/j.bone.2015.08.002
26. Larsson S, Fazzalari NL. Anti-osteoporosis therapy and fracture healing. Arch Orthop Trauma Surg. Feb 2014;134(2):291-7. doi: https://doi.org/10.1007/s00402-012-1558-8
27. Kates SL, Ackert-Bicknell CL. How do bisphosphonates affect fracture healing? Injury. Jan 2016;47 Suppl 1(0 1):S65-8. doi: https://doi.org/10.1016/S0020-1383(16)30015-8
28. Gorter EA, Reinders CR, Krijnen P, et al. The effect of osteoporosis and its treatment on fracture healing a systematic review of animal and clinical studies. Bone Rep. Dec 2021;15:101117. doi: https://doi.org/10.1016/j.bonr.2021.101117
29. Begkas D, Pastroudis A, Touzopoulos P, et al. The Effects of Long-term Use of Nitrogen-containing Bisphosphonates on Fracture Healing. Cureus. Mar 25 2019;11(3):e4307. doi: https://doi.org/10.7759/cureus.4307
30. Kidd LJ, Cowling NR, Wu AC, et al. Bisphosphonate treatment delays stress fracture remodeling in the rat ulna. J Orthop Res. Dec 2011;29(12):1827-33. doi: https://doi.org/10.1002/jor.21464
31. Amanat N, McDonald M, Godfrey C, et al. Optimal timing of a single dose of zoledronic acid to increase strength in rat fracture repair. J Bone Miner Res. Jun 2007;22(6):867-76. doi: https://doi.org/10.1359/jbmr.070318
32. Allen MR, Aref MW. What Animal Models Have Taught Us About the Safety and Efficacy of Bisphosphonates in Chronic Kidney Disease. Curr Osteoporos Rep. Jun 2017;15(3):171-177. doi: https://doi.org/10.1007/s11914-017-0361-4
33. Damasiewicz MJ, Nickolas TL. Bisphosphonate therapy in CKD: the current state of affairs. Curr Opin Nephrol Hypertens. Mar 2020;29(2):221-226. doi: https://doi.org/10.1097/MNH.0000000000000585M
34. Allen MR, Chen NX, Gattone VH, et al. Skeletal effects of zoledronic acid in an animal model of chronic kidney disease. Osteoporos Int. Apr 2013;24(4):1471-81. doi: https://doi.org/10.1007/s00198-012-2103-x
35. Moe SM, Chen NX, Newman CL, et al. A comparison of calcium to zoledronic acid for improvement of cortical bone in an animal model of CKD. J Bone Miner Res. Apr 2014;29(4):902-10. doi: https://doi.org/10.1002/jbmr.2089
36. Aguirre JI, Castillo EJ, Kimmel DB. Preclinical models of medication-related osteonecrosis of the jaw (MRONJ). Bone. Dec 2021;153:116184. doi: https://doi.org/10.1016/j.bone.2021.116184
37. Tetradis S, Allen MR, Ruggiero SL. Pathophysiology of Medication-Related Osteonecrosis of the Jaw-A Minireview. JBMR Plus. Aug 2023;7(8):e10785. doi: https://doi.org/10.1002/jbm4.10785
Об авторах
Н. В. ТоропцоваФГБНУ Научно-исследовательский институт ревматологии им. В.А. Насоновой
Россия
Торопцова Наталья Владимировна - доктор медицинских наук, заведующий лабораторией остеопороза.
Москва
ResearcherID: I-9030-2017; Scopus Author ID: 6507457856
Конфликт интересов:
Нет
И. А. Баранова
Россия
Баранова Ирина Александровна - д.м.н., профессор, профессор кафедры госпитальной терапии педиатрического факультета.
Москва
ResearcherID: J-3667-2017; Scopus Author ID: 7006313142
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Строение неорганического пирофосфата и БФ. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(222KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Строение бисфосфонатов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(273KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Влияние азотсодержащих бисфосфонатов на мевалонатный путь синтеза холестерина. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(294KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Торопцова Н.В., Баранова И.А. Современные представления о механизме действия бисфосфонатов. Влияние длительного приема бисфосфонатов на костную ткань (доклинические исследования). Остеопороз и остеопатии. 2023;26(3):4-11. https://doi.org/10.14341/osteo13147
For citation:
Toroptsova N.V., Baranova I.A. Current vision on mechanism of action of bisphosphonates. The effect of long-term administration of bisphosphonates on bone tissue (preclinical studies). Osteoporosis and Bone Diseases. 2023;26(3):4-11. (In Russ.) https://doi.org/10.14341/osteo13147

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































