Перейти к:
Вторичный гиперпаратиреоз при хронической болезни почек у пациентов с сахарным диабетом: роль дефицита витамина D
https://doi.org/10.14341/osteo13152
Аннотация
ОБОСНОВАНИЕ. Дефицит витамина D при вторичном гиперпаратиреозе (ВГПТ) на фоне хронической болезни почек (ХБП) у пациентов с сахарным диабетом (СД) является одним из ключевых факторов ухудшения функционирования почечного звена.
ЦЕЛЬ. Оценить показатели кальций-фосфорного обмена у лиц с ВГПТ на фоне ХБП, СД и без него для оптимизации подходов к лечению.
МАТЕРИАЛЫ И МЕТОДЫ. Проведен ретроспективный анализ 416 историй болезни с диагнозами ХБПС3-С5 и ВГПТ, из которых 112 имели в анамнезе СД, находившиеся на обследовании и лечении в нефрологическом отделении в период с 01. 01. 2018 по 31. 12. 2022 гг. Изучены демографические и антропометрические данные, оценены лабораторные (общий и ионизированный кальций, общий белок, альбумин, фосфор, креатинин, паратиреоидный гормон, 25(OH)D,
щелочная фосфатаза) и инструментальные (ЭХО-КГ, УЗИ органов брюшной полости и забрюшинного пространства) методы исследования.
РЕЗУЛЬТАТЫ. СД является ведущей причиной ХБП среди всех нозологических форм. Уровень 25(OH)D у пациентов без СД варьировал от 9,04 до 152 нмоль/л, с СД — от 8,3 до 77 нмоль/л. Средний уровень 25(OH)D у пациентов без СД (41,7 ± 26,1 нмоль/л) достоверно выше, чем у пациентов с СД1 (20,3 ± 14,9 нмоль/л) и СД2 (27,6 ± 19,2 нмоль/л) (р = 0,005 и р = 0,003 соответственно). Дефицит и недостаточность 25(OH)D чаще регистрировались у пациентов с СД в сравнении с пациентами без СД (89 и 10 % против 69 и 19 % соответственно), при этом оптимальный уровень чаще встречался у пациентов без СД (12 и 1 % соответственно).
Ключевые слова
Для цитирования:
Авдеева В.А., Сячина С.Н., Суплотова Л.А. Вторичный гиперпаратиреоз при хронической болезни почек у пациентов с сахарным диабетом: роль дефицита витамина D. Остеопороз и остеопатии. 2024;27(1):35-41. https://doi.org/10.14341/osteo13152
For citation:
Avdeeva V.A., Syachina S.N., Suplotova L.A. Secondary hyperparathyroidism in chronic kidney disease in patients with diabetes mellitus: the role of vitamin D deficiency. Osteoporosis and Bone Diseases. 2024;27(1):35-41. (In Russ.) https://doi.org/10.14341/osteo13152
ОБОСНОВАНИЕ
История создания KDIGO (Kidney Disease: Improving Global Outcomes) как глобальной организации, разрабатывающей и внедряющей клинические рекомендации по тактике ведения пациентов с заболеваниями почек, берет свое начало с конца XX века [1]. Основной фокус исследований KDIGO нацелен на хроническую болезнь почек (ХБП) — естественный и неизбежный исход практически всех нефропатий независимо от их этиологической причины, при которых функция почек неуклонно снижается. Это обусловлено высокой распространенностью ХБП во всем мире, которая приобретает характер неинфекционной эпидемии и достигает 13,4% (11,7—15,1%) [2], что сопоставимо с такими социально значимыми заболеваниями, как гипертоническая болезнь, ожирение и сахарный диабет (СД). Признаки повреждения почек и/или снижение скорости клубочковой фильтрации (СКФ) выявляют у 40–50% пациентов с СД [3], что связано с комбинацией взаимосвязанных нарушений: метаболических, гемодинамических, а также развитием процессов воспаления и фиброза [4]. В настоящее время СД является основной причиной ХБП во всем мире [5]. Течение СД на фоне непрерывно угасающей функциональной способности нефронов представляет собой дополнительный отягощающий фактор, который в сочетании с системными осложнениями ХБП, такими как артериальная гипертензия и связанные с ней сердечно-сосудистые заболевания, анемия и минерально-костные нарушения (МКН), негативно влияют на качество и продолжительность жизни таких пациентов. В 2017 г. KDIGO определил МКН при ХБП как системную патологию костного и минерального гомеостаза, сопровождающуюся либо отклонениями в показателях фосфорно-кальциевого обмена с развитием вторичного гиперпаратиреоза (ВГПТ): дефектами обмена кости, ее минерализаций, объемом, линейным ростом или ее прочностью; сосудистой или тканевой кальцификацией либо сочетанием этих факторов [6]. При этом центральным патогенетическим звеном развития ВГПТ у пациентов с ХБП является снижение концентрации активной формы витамина D [7].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить показатели кальций-фосфорного обмена у лиц с ВГПТ на фоне ХБП, СД и без него для оптимизации подходов к лечению.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование проведено на базе нефрологического отделения ГБУЗ ТО «Областная клиническая больница №1» г. Тюмени
Время проведения. С 01.01.2018 по 31.12.2022 гг., исключая период перепрофилирования отделения в моноинфекционный госпиталь по оказанию помощи больным с новой коронавирусной инфекцией COVID-19 (с 03.2020 по 05.2022 гг).
Изучаемые популяции
Критерии включения: возраст старше 18 лет, ХБП С3–С5 и ВГПТ на момент поступления в стационар, отсутствие приема витамина D по данным истории болезни. Диагноз ХБП выставлен в соответствии с клиническими рекомендациями KDIGO 2021 г. [8]. Скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) [9]. ХБП 3 стадии соответствовала СКФ от 59 до 30 мл/мин, 4 стадии — 29–15 мл/мин, 5 стадии — <15 мл/мин и/или пациенты, находящиеся на программном гемодиализе. Классификация альбуминурии: А1<10–29 мг/сут., А2 — 30–299 мг/сут., А3 — 300–1999 мг/сут. (соответствует суточной протеинурии ≥0,5 г.), А4≥2000 мг/сут. (соответствует суточной протеинурии ≥3,5 г.). Диагноз ВГПТ выставлен на основании утвержденных клинических рекомендаций по хронической болезни почек 2023 г. [10].
Критерии исключения: возраст до 18 лет, ХБПС1-С2, первичный и третичный гиперпаратиреоз.
Способ формирования выборки из изучаемой популяции на I этапе.
С целью поиска наиболее частой этиологической причины ХБП отобраны истории болезни пациентов с диагнозами ХБП С3–С5 и вторичным гиперпаратиреозом (ВГПТ) в анамнезе.
Дизайн исследования I этапа.
Одноцентровое, ретроспективное, обсервационное, одномоментное, сплошное, одновыборочное, неконтролируемое исследование.
Способ формирования выборки из изучаемой популяции для II этапа.
С целью сравнения степени выраженности лабораторных изменений ВГПТ отобранные лица были распределены на 3 группы: 1 группа — пациенты без патологии углеводного обмена в анамнезе, 2 группа — имеющие подтвержденный диагноз сахарного диабета 1 типа (СД1) и 3 группа — пациенты с сахарным диабетом 2 типа (СД2).
Дизайн исследования II этапа.
Одноцентровое, ретроспективное, обсервационное, одномоментное, двухвыборочное, неконтролируемое исследование.
Уровень 25(ОН)D установлен согласно классификации, принятой Российской ассоциацией эндокринологов [11].
Методы
Сбор данных историй болезни осуществлялся согласно единому протоколу (сбор жалоб, анамнеза основного заболевания и сопутствующей патологии, анамнеза жизни, данных физикального обследования с измерением роста, веса и расчетом ИМТ). Лабораторные исследования проводили по стандартным методикам в центральной лаборатории ГБУЗ ТО «Областная клиническая больница №1» г. Тюмени на биохимическом анализаторе (Roshe HITACHI cobas 6000). Из лабораторных методов исследовался уровень общего кальция (референсные значения: 2,25–2,75 ммоль/л), общего белка (65–85 г/л), альбумина (35–53 г/л), ПТГ (15–65 пг/мл), ионизированного кальция (1,16–1,32 ммоль/л), фосфора (0,8–1,45 ммоль/л), 25(OH)D (75–250 нмоль/л), креатинина (44–80 мкмоль/л для женщин, 74–110 мкмоль/л для мужчин), щелочная фосфатаза (ЩФ) (44–147 Ед/л).
Статистический анализ
Статистическую обработку полученных данных проводили с использованием программы Microsoft Office Excel 2010, версия: 14.0.4760.1000 (64-разрядная). Оценку нормальности распределения количественных признаков проводили с использованием теста Колмогорова-Смирнова. Среднее значение обозначалось с указанием стандартного отклонения (M±SD). Для сравнения двух независимых групп использовали параметрический t-критерий Стьюдента. Статистически значимым считался критерий при р<0,05.
Этическая экспертиза
Проведение исследования одобрено на заседании этического комитета ФГБОУ ВО «Тюменский ГМУ» Минздрава России от 21.11.2023 г. №117.
РЕЗУЛЬТАТЫ
В Тюменской области маршрутизация пациентов с ХБП осуществляется в единый областной нефрологический центр, основанный на базе ГБУЗ ТО «Областная клиническая больница №1» г. Тюмени (приказ Департамента здравоохранения Тюменской области №20/15 от 16 августа 2018 г.). Для определения наиболее частой этиологической причины ХБП были отобраны истории болезни пациентов (n=416) с установленным диагнозом ХБП С3–С5 и ВГПТ. По результатам I этапа исследования установлено, что СД занимает первое место среди всех причин ХБП в сочетании с ВГПТ (27%), опережая нозологические причины поражения почек и другие патологические состояния (рис. 1).
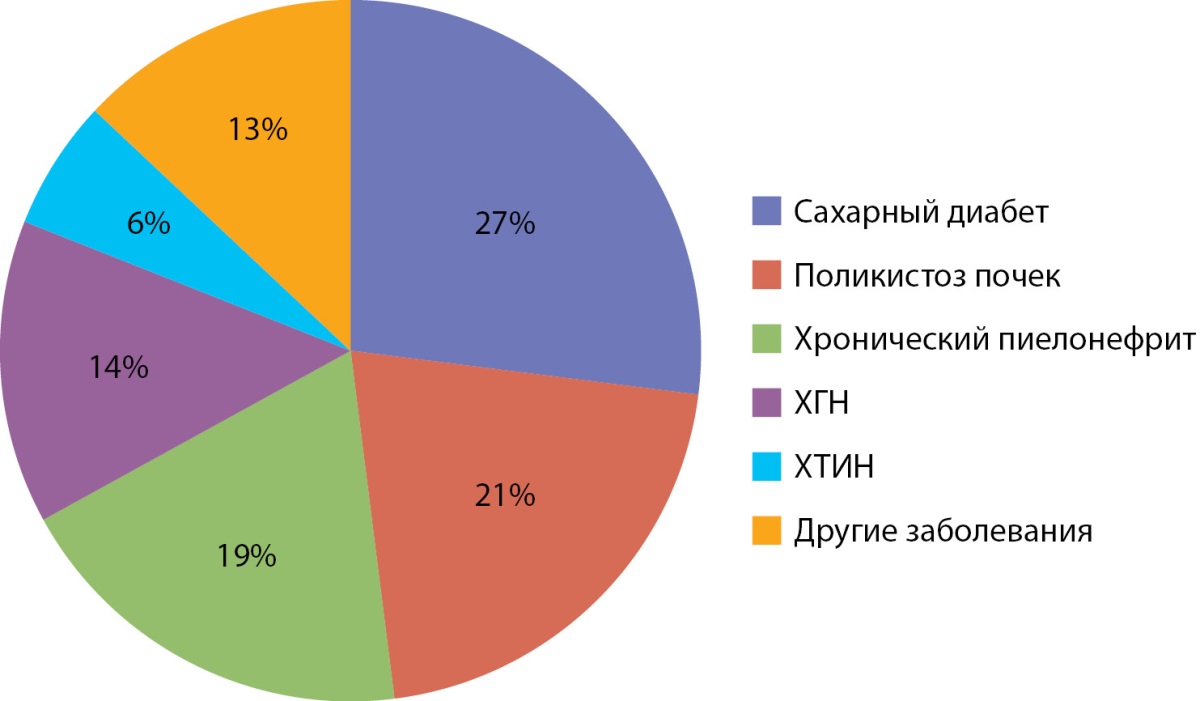
Рисунок 1. Структура причин ХБП у пациентов с ВГПТ
Для II этапа все пациенты были распределены на 3 группы: 1 группа — пациенты без СД в анамнезе (73%), 2 группа — имеющие подтвержденный диагноз СД1 (4%) и 3 группа — пациенты с СД2 (23%). Группа пациентов без СД представлена женщинами в 52% (n=159), мужчинами в 48% (n=145), средний возраст составил 55,7±14,1 года. Среди пациентов с СД1 также преобладали женщины — 71% (n=12), как и при СД2 (64%, n= 61). Средний возраст пациентов с СД1 составил 36,4±11,3 года, СД2 — 63,6±8,5 года. Длительность СД1 в среднем составила 22,5±9,1 года, с СД2 — 12,8±7,1 года. На момент поступления ДН была установлена у 72% (n=81) пациентов, из которых с СД1 — 20% (n=16) и СД2 — 80% (n=65). При этом среди всех пациентов с СД1 (n=17) частота встречаемости ДН составила 94% (n=16), в то время как у пациентов с СД2 (n=95) — 62% (n=65). Чаще ДН выявлялась на 2-й и 3-й стадиях (46,2% и 28,9% соответственно). Среди сопутствующей патологии у пациентов с СД2 наиболее часто регистрировалась ИБС в сравнении с пациентами с СД1 и без углеводных нарушений (47, 6 и 21% соответственно) (табл. 1).
Таблица 1. Общая характеристика исследуемых групп
|
Показатель |
без СД (1 группа) |
с СД1 (2 группа) |
с СД2 (3 группа) |
|
Количество исследуемых, n |
304 |
17 |
95 |
|
Пол %, n |
М 48%, n=145 Ж 52%, n=159 |
М 29%, n=5 Ж 71%, n=12 |
М 36%, n=34 Ж 64%, n= 61 |
|
Возраст, лет M±SD |
55,7±14,1 года |
36,4±11,3 года |
63,6±8,5 года |
|
Длительность заболевания СД M±SD |
- |
22,5±9,1 года |
12,8±7,1 года |
|
Диабетическая нефропатия %, n |
- |
20%, n=16 |
80%, n=65 |
|
Сопутствующая патология %, n |
АГ 90% (n=257); ИБС 21% (n=64) |
АГ 100% (n=17); ИБС 6% (n=1) |
АГ 97% (n=92); ИБС 47% (n=45) |
По результатам II этапа при сравнении степени выраженности лабораторных изменений ВГПТ среди пациентов с углеводными нарушениями и без них выявлено, что исследуемые группы были статистически сопоставимы, за исключением уровня сывороточного креатинина, ПТГ и 25(OH)D (табл. 2). Уровень 25(OH)D у пациентов с СД варьировал от 8,3 до 77 нмоль/л, без СД — от 9,04 до 152 нмоль/л. Средний уровень 25(OH)D у пациентов без СД (41,7±26,1 нмоль/л) достоверно выше, чем у пациентов с СД1 (20,3±14,9 нмоль/л) и СД2 (27,6±19,2 нмоль/л) (р=0,005 и р=0,003 соответственно). Дефицит и недостаточность 25(OH)D чаще регистрировались у пациентов с СД в сравнении с пациентами без углеводных нарушений (89 и 10% против 69 и 19% соответственно), при этом оптимальный уровень чаще встречался у пациентов без СД (12 и 1% соответственно) (рис. 2). Более выраженный дефицит 25(OH)D у пациентов с ХБП и СД, вероятнее всего, обусловлен не только причинами, связанными с алиментарным дефицитом витамина D в питании и недостаточным пребыванием на солнце, но и особенностями его метаболизма у данной категории пациентов.
Таблица 2. Сравнительный анализ лабораторных показателей кальций-фосфорного обмена
исследуемых групп
|
Показатель |
без СД (1 группа) |
с СД1 (2 группа) |
с СД2 (3 группа) |
р1-2 |
р1-3 |
р2-3 |
|
Общий кальций, ммоль/л М±SD (n=304) — 1 группа (n=17) — 2 группа (n=93) — 3 группа |
2,1±0,2 |
2,1±0,2 |
2,2±0,3 |
0,07 |
0,4 |
0,3 |
|
Общий белок, г/л М±SD (n=301) — 1 группа (n=17) — 2 группа (n=92) — 3 группа |
66,9±9,2 |
60,8±7,3 |
66,7±7,5 |
0,054 |
0,9 |
0,076 |
|
Альбумин, г/л М±SD (n=124) — 1 группа (n=4) — 2 группа (n=31) — 3 группа |
41±8,7 |
39,3±7,3 |
39±9,3 |
0,7 |
0,2 |
0,9 |
|
ПТГ, пг/мл М±SD (n=276) — 1 группа (n=16) — 2 группа (n=82) — 3 группа |
378,4±389,3 |
221,8±125,2 |
248,9±214,4 |
0,002* |
0,0001* |
0,6 |
|
Кальций ионизированный, ммоль/л М±SD (n=234) — 1 группа (n=16) — 2 группа (n=72) — 3 группа |
1,1±0,1 |
1,09±0,1 |
1,08±0,1 |
0,6 |
0,2 |
0,7 |
|
Фосфор, ммоль/л М±SD (n=234) — 1 группа (n=13) — 2 группа (n=71) — 3 группа |
1,7±0,6 |
1,8±0,6 |
1,7±0,6 |
0,6 |
0,1 |
0,6 |
|
25(OH)D, нмоль/л М±SD (n=97) — 1 группа (n=4) — 2 группа (n=27) — 3 группа |
41,7±26,1 |
20,3±14,9 |
27,6±19,2 |
0,005* |
0,003* |
0,5 |
|
Креатинин, мкмоль/л М ± SD (n=304) — 1 группа (n=17) — 2 группа (n=95) — 3 группа |
440,2±266,3 |
518,9±306,8 |
427,4±254,6 |
0,8 |
0,0008* |
0,3 |
|
ЩФ, Ед/л М±SD (n=217) — 1 группа (n=15) — 2 группа (n=64) — 3 группа |
153,3±120,5 |
189,7±251,7 |
167,9±116,1 |
0,6 |
0,4 |
0,8 |
* р<0,05 — статистически значимо.
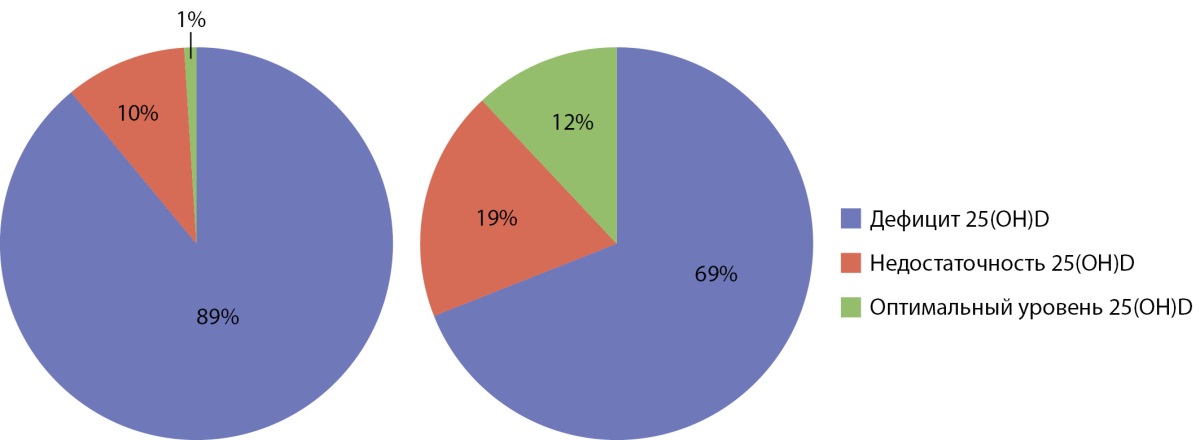
Рисунок 2. Уровень 25(OH)D у пациентов с СД (слева) и без углеводных нарушений (справа)
ОБСУЖДЕНИЕ
По последним прогнозам экспертов, к 2040 г. ХБП станет пятой по значимости причиной смерти среди населения [12], а заболеваемость СД в аналогичном году возрастет до 642 миллионов человек во всем мире [13]. Дуэт ХБП и СД представляет собой глобальные вызовы здравоохранению XXI века, поскольку характеризуется неуклонно нарастающей распространенностью в популяции, инвалидизирующими осложнениями и высокими показателями смертности. Диабетическая болезнь почек (ДБП) является основной причиной терминальной стадии заболевания почек во всем мире, развивающейся как итог взаимоотягощающей комбинации ВГПТ, ХБП и СД, в патогенезе которых важная роль отводится дефициту витамина D. В настоящем обсуждении рассмотрен вопрос влияния витамина D на развитие и течение ХБП у пациентов с СД, а также проанализирована возможность применения добавок витамина D в качестве дополнительного элемента терапии.
В 2010 г. Tervaert с соавт. сообщили о новой классификации поражений почек, включающей поражение канальцев, интерстиция и/или сосудов [14]. Такая классификация была необходима, поскольку у значительного процента больных с СД при нарушении почечной фильтрации не наблюдается повышенная экскреция белка с мочой. Кроме того, у многих пациентов с СД1 наблюдается протеинурия без сопутствующих изменений СКФ. Интересно, что классические стадии нефропатии могут не встречаться у пациентов с СД2, поскольку в таком случае вклад в почечное повреждение вносят и ряд других факторов, что практически не позволяет дифференцировать классическую ДН, основанную на определении экскреции белка. Поскольку исследования осложнений СД, в частности нефропатии, зачастую носят обсервационный характер и не содержат данных биопсии ДН, в англоязычной литературе термин ДН реклассифицировали в понятие ДБП. Установлено, что пациенты с любым типом СД и низким уровнем витамина D в сыворотке крови подвергаются повышенному риску развития ДБП с последующим прогрессирующим ухудшением почечной функции [15–19]. Так, в ретроспективном, обсервационном исследовании с участием 240 пациентов с ХБП и 60 пациентов без нее изучалась связь уровней 25(OH)D с функцией почек на различных стадиях ХБП. Пациенты были сгруппированы в зависимости от стадии ХБП. По результатам уровни 25(OH)D в сыворотке были значительно ниже у пациентов с ХБП, чем у пациентов без ХБП (p<0,05) и положительно коррелировали со стадией ХБП (ХБП 5: 7,74±2,90, ХБП 4: 8,44±2,53, ХБП 3: 10,31±3,36), по сравнению с контрольной группой: 29,43±10,15 нг/мл) [20]. В другом поперечном исследовании с участием 300 пациентов с СД показано, что наличие ХБП достоверно связано с дефицитом витамина D (p=0,043), при этом пациенты с ХБП в 1,7 раза чаще имели дефицит витамина D, чем пациенты без нее [21], что также нашло отражение и в проведенном исследовании. Ray S. с соавт. в своем перекрестном исследовании оценивали уровни витамина D у 72 пациентов с СД и впервые диагностированной ХБП 4 и 5 стадий. Уровень витамина D у больных ХБП 4-й стадии составил 19,15 (IQR 13,6–23,4) нг/мл, у больных с ХБП 5-й стадии — 10,95 (IQR 9,3–16,4) нг/мл (р=0,006). Также наблюдалась значительная отрицательная корреляция между уровнями альбумин-креатининового соотношения и 25(OH)D (p=0,002) [17]. Недавний систематический обзор и метаанализ оценили влияние применения витамина D на 1464 пациента с ДБП. Кальцитриол, альфакальцидол и витамин D3 не только уменьшали экскрецию белка с мочой, но и снижали уровни ключевых маркеров воспаления, включая высокочувствительный С-реактивный белок, TNF-α и IL-6, при этом не влияли на сывороточный креатинин, рСКФ или гликемический контроль [22]. Тем не менее рекомендации KDIGO, обновленные в 2017 г., декларируют корректировать дефицит и недостаточность витамина D при ХБП с СКФ <60 мл/мин/1,73 м с помощью лечебных стратегий, предоставляемых населению в целом, вне зависимости от наличия или отсутствия СД. Согласно тем же рекомендациям, при приеме добавок витамина D у пациентов на преддиализном этапе следует использовать нативные формы и резервировать лечение активными формами и его аналогами для более тяжелого или прогрессирующего течения ВГПТ [6]. Применения нативного витамина D вызывают растущий интерес в литературе, поскольку имеются доказательства активности фермента 1-α-гидроксилазы во внепочечных клетках, что дает возможность периферического превращения 25(OH)D в кальцитриол [23]. В таблице 3 суммированы рандомизированные контролируемые исследования (РКИ), которые оценивали применения колекальциферола по биохимическим и клинически значимым конечным точкам [24].
Таблица 3. Результаты РКИ по добавкам колекальциферола
у лиц на преддиализной стадии ХБП (адаптировано из [25])
|
Автор, год |
Участники, стадия ХБП |
Вид нативного витамина D, доза и сравнение |
Продолжительность исследования |
25(OH)D нг/мл, [до/после] |
Дополнительные примечания |
|
Wetmore et al., 2016 |
44, ХБП С3–С5 |
А: Холекальциферол |
12 недель |
А: 45,0 [ 20,9–65,9] |
↔ 1,25(OH) 2D в обеих группах |
|
Б: Эргокальциферол |
Б: 30,7 [ 20,5–51,2] |
||||
|
Kendrick et al., 2017 |
128, ХБП С3б–С4 |
А: Холекальциферол 2000 МЕ/день |
24 недель |
А: 11,8 [ 23,0–34,8] |
- |
|
Б: Кальцитриол 0,5 мкг/сутки |
Б: 0,5 [ 21,7–21,2] |
||||
|
Kumar et al., 2017 |
120, ХБП С3–С4 |
А: Холекальциферол |
16 недель |
А: 24,91 [ 13,40–38,31] |
↑1,25(OH) 2 D ↑эндотелиальная функция ↓риск сердечно-сосудистых осложнений |
|
Б: Плацебо |
Б: 1,51 [ 13,21–14,72] |
ЗАКЛЮЧЕНИЕ
СД является ведущей причиной ХБП. Дефицит витамина D часто встречается при ХБП и играет важную роль в патогенезе ВГПТ у пациентов c СД. В настоящее время многочисленные исследования утверждают, что витамин D является возможным ренопротектором, однако до сих пор остается открытым вопрос оптимальной дозировки и формы витамина D, которая позволит эффективно уменьшить риск развития и/или замедлить прогрессирование поражения почек у пациентов с СД.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Авдеева В.А. — написание основного текста рукописи; Сячина С.Н. — обработка полученных данных; Суплотова Л.А. — редактирование основного текста рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой ее части.
Список литературы
1. https://kdigo.org/wp-content/uploads/2019/07/KDIGO_2018-Annual-Report.pdf. Электронный ресурс (дата обращения 03. 10. 2023)
2. Румянцева Е.И. Хроническая болезнь почек как глобальная проблема для общественного здоровья: динамика заболеваемости и смертности // Проблемы стандартизации в здравоохранении. — 2021. — Т. 1. — № 2. — С. 41-49. doi: 10.26347/1607-2502202101-02041-049
3. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Эпидемиологические характеристики сахарного диабета в Российской Федерации: клинико-статистический анализ по данным Федерального регистра сахарного диабета на 01. 01. 2021 // Сахарный диабет. — 2021. — Т. 24. — № 3. — С. 204-221. doi: 10.14341/DM12759
4. Chaudhuri А, Ghanim H, Arora P. Improving residual risk of renal and cardiovascular outcomes in dkd: review of pathophysiology, mechanisms and evidence from recent trials. Diabetes Obes Metab. 2022;24(3):365-376. doi: 10.1111/dom.14601
5. George C, Echouffo-Tcheugui JB, Jaar BG, et al. The need for screening, early diagnosis, and prediction of chronic kidney disease in people with diabetes in low-and-middle income countries-a review of the current literature. BMC Med. 2022;20(1):247. doi: 10.1186/s12916-022-02438-6
6. Kidney Disease: Improving Global Outcomes (KDIGO) CD-MBD Work Group. KDIGO 2017 clinical practice guideline update for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease – mineral and bone disorder (CKD-MBD). Kidney Int Suppl. 2017;7(1):1. doi: 10.1016/j.kisu.2017.04.001
7. Егшатян Л.В., Мокрышева Н.Г. Вторичный гиперпаратиреоз при хронической болезни почек 3–4 стадии у пациента с сахарным диабетом 2 типа // Сахарный диабет. — 2018. — Т. 21. — № 2. — С. 128-134. doi: 10.14341/DM9458
8. https://kdigo.org/wp-content/uploads/2022/12/Russian-Translation-KDIGO-2021-Glomerular-Diseases-Guideline.pdf. Электронный ресурс (дата обращения 03.10.2023)
9. https://euat.ru/education/calculator-egfr. Электронный ресурс (дата обращения 03. 10. 2023)
10. Бобкова И.Н., Ватазин А.В., Ветчинникова О.Н. и др. // Клинические рекомендации ассоциации нефрологов. Хроническая болезнь почек (ХБП). 2023 г.: 233С.
11. Дедов И.И., Мельниченко Г.А., Белая Ж.Е. и другие // Клинические рекомендации Российской ассоциации эндокринологов по дефициту витамина D. — 2021 г.: 61 c.
12. Foreman KJ, Marquez N, Dolgert A, et al. Forecasting life expectancy, years of life lost, and all-cause and cause-specific mortality for 250 causes of death: reference and alternative scenarios for 2016–40 for 195 countries and territories. The Lancet. 2018;392:2052–2090. doi: 10.1016/S0140-6736(18)31694-5
13. International Diabetes Federation. IDF Diabetes Atlas, 10<sup>th</sup> edn. Brussels, Belgium:International Diabetes Federation, 2021.
14. Tervaert Thijs W Cohen, Mooyaart Antien L, Amann Kerstin, et al. On behalf of the Renal Pathology Society. Pathologic Classification of Diabetic Nephropathy. Journal of the American Society of Nephrology. 2010;21(4):556-563. doi: 10.1681/ASN.2010010010
15. Liu Q, Sun J, Xu T, Bian G, Yang F. Associations of serum amyloid A and 25‐hydroxyvitamin D with diabetic nephropathy: A cross‐sectional study. J Clin Lab Anal. 2022;36(3). doi: 10.1002/jcla.24283
16. Zhou T, Shen L, Li Z, et al. Severe 25-Hydroxyvitamin D Deficiency May Predict Poor Renal Outcomes in Patients With Biopsy-Proven Diabetic Nephropathy. Front Endocrinol (Lausanne). 2022;13. doi: 10.3389/fendo.2022.871571
17. Ray S, Beatrice AM, Ghosh A, et al. Profile of chronic kidney disease related-mineral bone disorders in newly diagnosed advanced predialysis diabetic kidney disease patients: A hospital based cross-sectional study. Diabetes Metab Syndr Clin Res Rev. 2017;11:S931-S937. doi: 10.1016/j.dsx.2017.07.019
18. Duan S, Lu F, Wu B, et al. Association of Serum 25 (OH) Vitamin D With Chronic Kidney Disease Progression in Type 2 Diabetes. Front. Endocrinol. 2022;13:929598. doi: 10.3389/fendo.2022.929598
19. Xu F, Lu H, Lai T, et al. Chen Y. Association between Vitamin D Status and Mortality among Adults with Diabetic Kidney Disease. J. Diabetes Res. 2022;2022:9632355. doi: 10.1155/2022/9632355
20. Xiao X, Wang Y, Hou Y, et al. Vitamin D deficiency and related risk factors in patients with diabetic nephropathy. J. Int. Med. Res. 2016;44:673–684. doi: 10.1177/0300060515593765.
21. Jamal Shahwan M, Hassan NAG, Shaheen RA. Assessment of kidney function and associated risk factors among type 2 diabetic patients. Diabetes Metab. Syndr. 2019;13:2661–2665. doi: 10.1016/j.dsx.2019.07.025
22. Wang Y, Yang S, Zhou Q, et al. Effects of Vitamin D Supplementation on Renal Function, Inflammation and Glycemic Control in Patients with Diabetic Nephropathy : A Systematic Review and Meta-Analysis. Kidney Blood Press Res. 2019;44:72–87. doi: 10.1159/000498838
23. Friedl C, Zitt E. Vitamin D prohormone in the treatment of secondary hyperparathyroidism in patients with chronic kidney disease. Int J Nephrol Renovasc Dis, 10 (2017), pp. 109-122. doi 10.2147/IJNRD.S97637
24. Cardoso MP, Pereira LAL. Native vitamin D in pre-dialysis chronic kidney disease. Nefrologia (Engl Ed). 2019;39(1):18-28. English, Spanish. doi: 10.1016/j.nefro.2018.07.004
Об авторах
В. А. АвдееваРоссия
Валерия Александровна Авдеева, к. м. н.
625023; ул. Одесская, д. 54; Тюмень
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
С. Н. Сячина
Россия
Софья Николаевна Сячина, терапевт
625023; ул. Одесская, д. 54; Тюмень
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Л. А. Суплотова
Россия
Людмила Александровна Суплотова, д. м. н., профессор
Тюмень
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Структура причин ХБП у пациентов с ВГПТ | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(112KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Уровень 25(OH)D у пациентов с СД (слева) и без углеводных нарушений (справа) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(113KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Авдеева В.А., Сячина С.Н., Суплотова Л.А. Вторичный гиперпаратиреоз при хронической болезни почек у пациентов с сахарным диабетом: роль дефицита витамина D. Остеопороз и остеопатии. 2024;27(1):35-41. https://doi.org/10.14341/osteo13152
For citation:
Avdeeva V.A., Syachina S.N., Suplotova L.A. Secondary hyperparathyroidism in chronic kidney disease in patients with diabetes mellitus: the role of vitamin D deficiency. Osteoporosis and Bone Diseases. 2024;27(1):35-41. (In Russ.) https://doi.org/10.14341/osteo13152

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).





































