Перейти к:
Опыт длительного применения деносумаба у женщин с остеопорозом и различными сопутствующими заболеваниями
https://doi.org/10.14341/osteo12922
Аннотация
Обоснование. Возможные различия в результатах спланированных РКИ и реальной клинической практики явились поводом для анализа длительной терапии деносумабом у пациенток с остеопорозом (ОП) различного генеза в амбулаторных условиях.
Цель. Оценить эффективность длительного лечения деносумабом по влиянию на МПК и маркеры костного метаболизма, переносимость и последствия отмены препарата у пациенток с ОП различной этиологии.
Материалы и методы. Проведен ретроспективный анализ амбулаторных карт женщин с ОП различной этиологии, наблюдавшихся в ФГБУ «НМИЦ ТПМ» от 1 до 10 лет и регулярно получавших деносумаб 60 мг 1 раз в 6 месяцев подкожно (минимум 2 инъекции). Всем проводились: осмотр и антропометрическое исследование; двухэнергетическая рентгеновская абсорбциометрия поясничного отдела позвоночника (L1-L4) и проксимального отдела бедра (ПОБ); лабораторные исследования: маркер костной резорбции СТх (β-crosslaps) в сыворотке крови; опрос о наличии нежелательных явлений.
Результаты. В исследование включено 148 пациенток, которые были разделены на 2 группы: 1 группа (N=98) – не принимавшие, 2 группа (N=50) – принимавшие антиостеопорозную терапию (АТ) до назначения деносумаба. Длительная терапия деносумабом ассоциировалась с неуклонным достоверным увеличением МПК в позвоночнике и ПОБ, а также снижением концентрации СТх в сыворотке крови как у не принимавших, так и у принимавших ранее АТ. У 54% пациенток МПК в позвоночнике достигла значений остеопении, у 43,4% женщин определялись целевые значения МПК в шейке бедра (Т-критерий ≥-2,0 SD). В течение первого года терапии отмечалось снижение концентрации СТх на 67% (р<0,001) у не принимавших и на 58% (р<0,001) у принимавших ранее АТ. Прекращение терапии деносумабом без последующего приема АТ ассоциировалось с достоверным снижением МПК в позвоночнике (на 4,4-8,2%) в течение первого года после отмены препарата.
Заключение. Терапия деносумабом эффективно повышает МПК в позвоночнике и ПОБ и снижает уровень СTx как у не леченых пациенток, так и у тех, кто ранее получал АТ. При необходимости прекращения терапии следует обсудить дальнейшую тактику ведения пациента для предотвращения «синдрома отмены».
Ключевые слова
Для цитирования:
Скрипникова И.А., Косматова О.В., Новиков В.Е., Мягкова М.А., Шишкова В.Н. Опыт длительного применения деносумаба у женщин с остеопорозом и различными сопутствующими заболеваниями. Остеопороз и остеопатии. 2021;24(2):48-55. https://doi.org/10.14341/osteo12922
For citation:
Skripnikova I.A., Kosmatova O.V., Novikov V.E., Myagkova M.A., Shishkova V.N. Experience of long-term use of denosumab in women with osteoporosis and various concomitant diseases. Osteoporosis and Bone Diseases. 2021;24(2):48-55. (In Russ.) https://doi.org/10.14341/osteo12922
ОБОСНОВАНИЕ
В настоящее время для лечения остеопороза (ОП) используются разные классы препаратов, эффективность которых доказана в рандомизированных плацебо-контролируемых исследованиях (РКИ). Одним из важных достижений фармакологической промышленности является разработка «таргетных» препаратов, представляющих собой моноклональные антитела к определенным белкам, которые находят все более широкое применение в терапии различных заболеваний. Таким препаратом, зарегистрированным в Российской Федерации в 2011г для лечения ОП, является Деносумаб. Деносумаб представляет собой полностью человеческое моноклоналное антитело к RANK-лиганду и осуществляет свое действие в регуляции цепи RANKL-RANK-OPG, основного регулятора костной резорбции, аналогично остеопротегерину.
Высокая эффективность деносумаба в снижении риска как позвоночных, так и периферических переломов у женщин в постменопаузе продемонстрирована в основном РКИ FREEDOM. В продлённой фазе этого исследования, помимо неуклонного роста минеральной плотности кости (МПК) во всех отделах скелета и стойкого подавления маркеров костного обмена, был также отмечен благоприятный профиль переносимости длительного (10-летнего) лечения деносумабом [1]. В мета-анализе, где сравнивалась эффективность деносумаба и, в основном, пероральных бисфосфонатов (БФ) (только одно исследование с парентеральными БФ) была показана равнозначная эффективность препаратов в отношении риска переломов и сходный профиль безопасности. Однако по силе антирезорбтивного эффекта и степени прироста МПК в позвоночнике, проксимальном отделе бедра (ПОБ) и предплечье деносумаб значимо превосходил БФ [2]. Особенность действия деносумаба на костную ткань заключается в том, что он реализует свое антирезорбтивное действие (препятствует образованию зрелых остеокластов), циркулируя в межклеточной жидкости, не связываясь с гидроксиапатитом костной ткани и не накапливаясь в ней, подобно БФ, что обусловливает отсутствие пролонгированного эффекта препарата и его обратимость. Клинически это может проявляется в быстрой потере МПК, увеличении концентрации маркеров костного метаболизма в крови и развитии переломов в течение первого года после выведения препарата из кровеносного русла [3-5]. Этот феномен получил название «синдром отмены» или «синдром рикошета».
Назначение деносумаба предпочтительно в ряде ситуаций: пациентам с почечной недостаточностью вне зависимости от скорости клубочковой фильтрации, поскольку деносумаб не влияет на почечную функцию [6], при более выраженном снижении МПК в ПОБ или предплечье, где доминирует кортикальная кость [7]. Кроме того, в РКИ показано, что деносумаб, назначенный пациентам, получавшим ранее терапию БФ, способен обеспечить им дополнительный эффект в плане повышения МПК и снижения концентрации маркеров костного метаболизма в большей степени, чем у пациенток, продолжавших лечение БФ, при аналогичном профиле переносимости [8][9]. После прекращения лечения деносумабом при повторном его назначении через 1 год отмечалось увеличение МПК до уровня, который был на момент отмены препарата, и снижение концентрации костных маркеров [10].
В настоящее время продолжаются поиски оптимальных схем и режимов терапии ОП, использующих преимущества тех или иных препаратов для достижения максимальной эффективности лечения. В систематическом обзоре Европейского общества кальцифицированных тканей (European Calcifi es Tissue Society, ECTS) в 2017г было рекомендовано оценивать эффективность терапии деносумабом не менее чем через 3 года, а у пациентов с высоким риском переломов продолжать лечение до 10 лет. При этом, у пациентов, достигших на фоне терапии деносумабом целевых значений Т-критерия в шейке бедра (-2,0 SD) и при отсутствии новых переломов, можно отменить терапию, но для предотвращения потери костной массы и развития переломов необходимо рассмотреть назначение БФ [11]. Аналогичная позиция в отношении тактики ведения пациентов была принята отечественными экспертами. Рекомендовано через 6 месяцев после прекращения лечения деносумабом (6 месяцев от последней инъекции) всем пациентам назначать таблетированные БФ или золедроновую кислоту. При назначении золедроновой кислоты требуется дополнительный перерыв до 65 дней [12].
Показаниями для назначения деносумаба являются: а) лечение постменопаузального ОП и ОП у мужчин при повышенном риске переломов; б) лечение потери костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, и у мужчин с раком предстательной железы, получающих гормон-депривационную терапию, при повышенном риске переломов; в) лечение потери костной массы, связанной с длительной терапией системными глюкокортикоидами, у взрослых пациентов при повышенном риске переломов.
Возможные различия в результатах спланированных РКИ и реальной клинической практики побудили нас проанализировать длительную терапию деносумабом у пациенток с ОП различного генеза и сопутствующими заболеваниями.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить эффективность длительного приема деносумаба по влиянию на МПК и маркеры костного метаболизма, переносимость и последствия отмены препарата у пациенток с ОП различной этиологии.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. ФГБУ «Национальный медицинский исследовательский центр терапии и профилактической медицины» МЗ РФ (НМИЦ ТПМ).
Время исследования. Январь 2010 – декабрь 2020.
Изучаемые популяции (одна или несколько)
Популяция женщин из числа обратившихся в консультативное отделение НМИЦ ТПМ с целью диагностики и лечения ОП.
Критерии включения:
- женский пол;
- установленной диагноз ОП различной этиологии;
- регулярное введение деносумаба 60 мг 1 раз в 6 месяцев подкожно за период от 1 до 10 лет (минимум 2 инъекции).
Критерии исключения: пропуск введения очередной дозы препарата.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Произвольный.
Дизайн исследования
Одноцентровое одновыборочное интервенционное динамическое ретроспективное исследование. Проведен ретроспективно анализ амбулаторных карт женщин с ОП, которым было назначено лечение деносумабом и продолжалось в течение от 1 до 10 лет.
Методы
Всем пациенткам проводились: осмотр и антропометрическое исследование; оценка риска переломов с использование калькулятора FRAX перед началом терапии; опрос о наличии нежелательных явлений; двухэнергетическая рентгеновская абсорбциометрия (DXA) поясничного отдела позвоночника (L1-L4) в задне-передней проекции и ПОБ на аппаратах Hologic Delpfi W (США) и Lunar Expert (США). Диагноз «остеопороз» устанавливали согласно классификации ВОЗ при Т-критерии -2,5 SD и ниже. Измерения в динамике выполнялись 1 раз в год на одном и том же приборе. Была проведена перекрестная калибровка оборудования, показатели МПК были унифицированы и приведены к показателям, используемым в базе Hologic с помощью поправочных коэффициентов. Определение общего кальция, общей щелочной фосфатазы и креатинина проводилось на биохимическом анализаторе Architectc8000 (Abbott, США). Маркер костной резорбции С-концевой телопептид коллагена 1 типа (СТх) исследовали в сыворотке крови методом твердофазного иммуноферментного анализа (β-crosslaps).
Статистический анализ
Статистическая обработка результатов проводилась при помощи программы SPSS 20.0 с использованием общепринятых методов параметрического и непараметрического анализа. Количественные переменные описывались числом параметров, средним арифметическим значением (М), стандартным отклонением от среднего арифметического значения (SD). Качественные переменные описывались абсолютными и относительными частотами (процентами). Достоверность различий между показателями оценивали с помощью стандартных критериев значимости: χ² Пирсона, парный и непарный критерий Стьюдента. Для параметров, распределение которых отличалось от нормального, использовали непараметрические тесты: при сравнении двух групп использовали парный корреляционный анализ по методу Спирмена, с определением двухсторонней значимости показателей. Различия считались статистически значимыми при р<0,05.
Этическая экспертиза
Исследование основано на ретроспективном анализе амбулаторных карт пациентов, которые официально получали консультацию в поликлинических условиях и назначение препарата согласно показаниям и установленному диагнозу, что не предусматривает этической экспертизы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После отбора амбулаторных карт согласно принятым критериям, в исследование было включено 148 женщин, регулярно принимавших деносумаб 60 мг 1 раз в 6 месяцев в течение периода от 1 до 10 лет. Только 4 пациентки получили инъекции через больший интервал времени (8-10 месяцев). 2 пациентки начали лечение деносумабом в других странах до регистрации препарата в РФ, а наблюдение проводилось в ФГБУ «НМИЦ ТПМ» МЗ РФ.
Для повышения эффективности и безопасности лечения, до начала терапии всем была определена концентрация витамина D (25(ОН)D) в сыворотке крови, после чего пациенткам с его недостаточностью или дефицитом проведено насыщение, согласно рекомендациям Российского общества по остеопорозу и Эндокринологического общества (50 000 МЕ в неделю в течение 4-8 недель) с последующим переходом на поддерживающий прием (800-2000 МЕ/сут) в зависимости от степени недостаточности витамина D. Также все пациенты принимали препараты кальция, его суточное потребление составляло не менее 1000-1200 мг [13][14].
Были выявлены следующие сопутствующие хронические заболевания: сахарный диабет 2 типа у 16 человек; язвенная болезнь желудка или 12-ти перстной кишки в стадии ремиссии у 14; целиалкия у 2; синдром «раздражённого кишечника» у 2; гипертоническая болезнь у 61; различные нарушения ритма сердца у 23; ИБС у 34; заболевания почек с клиренсом креатинина ≤30 мл/мин у 8; гипотиреоз, требующий приёма левотироксина в максимальной дозе 75 мкг, у 14 человек; 6 женщин принимали ингибиторы ароматазы после мастэктомии по поводу рака молочной железы. Глюкокортикоидный ОП выявлен у 6 человек с ревматоидным артритом, у 2 с бронхиальной астмой и у 1 с миастенией.
Все пациентки были разделены на 2 группы: 1 группа – не принимали антиостеопоретическую терапию (АТ) до назначения деносумаба, 2 группа – принимали ранее АТ. Почти все пациентки из 2 группы принимали до начала лечения деносумабом БФ в среднем 2,5 года и только четверо получали ранелат стронция или миакальцик в течение 3-4 лет. Среди них 70% получали пероральные БФ, 30% – парентеральные (золедроновую и ибадроновую кислоту). Смена терапии была обусловлена снижением МПК на фоне отмены препаратов или отсутствием положительной динамики МПК при приеме БФ, а также при развитии новых переломов. Медиана 10-летней вероятности основных переломов по FRAX у 98 пациенток, не получавших ранее АТ, составила 19,4 %, перелома шейки бедра (ШБ) – 4,9%, т.е. в исследование были включены пациенты с высоким и очень высоким риском переломов.
Общая характеристика пациентов представлена в таблице 1. Средний возраст пациенток составил 65,4±8,9 лет. Пациенты обеих групп были сопоставимы по основным параметрам на базовом уровне перед началом лечения деносумабом.
Таблица 1. Клинико-инструментальная характеристика пациенток.
Параметр | Общая группа (n=148) М±SD | 1 группа (n=98) М±SD | 2 группа (n=50) М±SD | р |
Возраст, лет | 65,4 ± 8,9 | 66,2 ± 8,7 | 63,3 ± 8,8 | 0,15 |
Возраст менопаузы, лет | 49,2 ± 2,4 | 49,5 ± 2,5 | 48,6 ± 2,06 | 0,52 |
Возраст установленного диагноза ОП, лет | 59,3 ± 8,9 | 61,3 ± 9,0 | 55,3 ± 7,3 | 0,06 |
Т-критерий L1-L4, SD | -3,1 ± 1,05 | -3,07 ± 1,02 | -3,27 ± 1,10 | 0,27 |
МПК L1-L4, г/см2 | 0,724 ± 0,13 | 0,719 ± 0,12 | 0,735 ± 0,15 | 0,50 |
Т-критерий ШБ, SD | -2,3 ± 0,62 | -2,28 ± 0,58 | -2,4 ± 0,67 | 0,14 |
МПК ШБ, г/см2 | 0,618 ± 0,11 | 0,610 ± 0,12 | 0,634± 0,08 | 0,22 |
Т-критерий ПОБ (Total), SD | -1,8 ± 0,66 | -1,7 ± 0,65 | -1,9 ± 0,66 | 0,22 |
МПК ПОБ (Total), г/см2 | 0,728 ± 0,09 | 0,733 ± 0,09 | 0,720 ± 0,09 | 0,45 |
Обще количество переломов, n | 139 | 85 | 54 | 0,09 |
Переломы позвонков, n | 65 (46,7%) | 36 (42,4%) | 29 (53,7%) | 0,25 |
Переломы бедра, n | 6 (4,3%) | 4 (4,7%) | 2 (3,7%) | 0,88 |
Переломы лучевой кости, n | 41 (29,5%) | 25 (29,4%) | 16 (29,6%) | 0,62 |
Другие переломы (ребра, голеностоп, локтевая кость), n | 27 (19,4%) | 20 (23,5%) | 7 (13%) | 0,51 |
Креатинин, мкмоль/л | 87 ± 8,2 | 86 ± 7,8 | 88 ± 9,6 | 0,64 |
Кальций общий, ммоль/л | 2,45 ± 0,08 | 2,46 ± 0,09 | 2,43 ± 0,07 | 0,52 |
Общая щелочная фосфатаза, Ед/л | 84 ± 19 | 85 ± 22 | 82 ± 18 | 0, 61 |
СТx в сыворотке крови, нг/мл | 0,520 ± 0,29 | 0,544 ± 0,28 | 0,470 ± 0,29 | 0,17 |
Примечание: p – между 1 и 2 группой; ОП – остеопороз; SD – стандартное отклонение; МПК – минеральная плотность кости; ШБ – шейка бедра; ПОБ – проксимальный отдел бедра; СТx – С-концевой телопептид коллагена 1 типа.
Динамика МПК и маркера костной резорбции СТx была прослежена на протяжении разного периода времени: от 1 до 10 лет. За весь период наблюдения отмечался неуклонный достоверный прирост МПК во всех обследованных участках скелета (рис. 1).
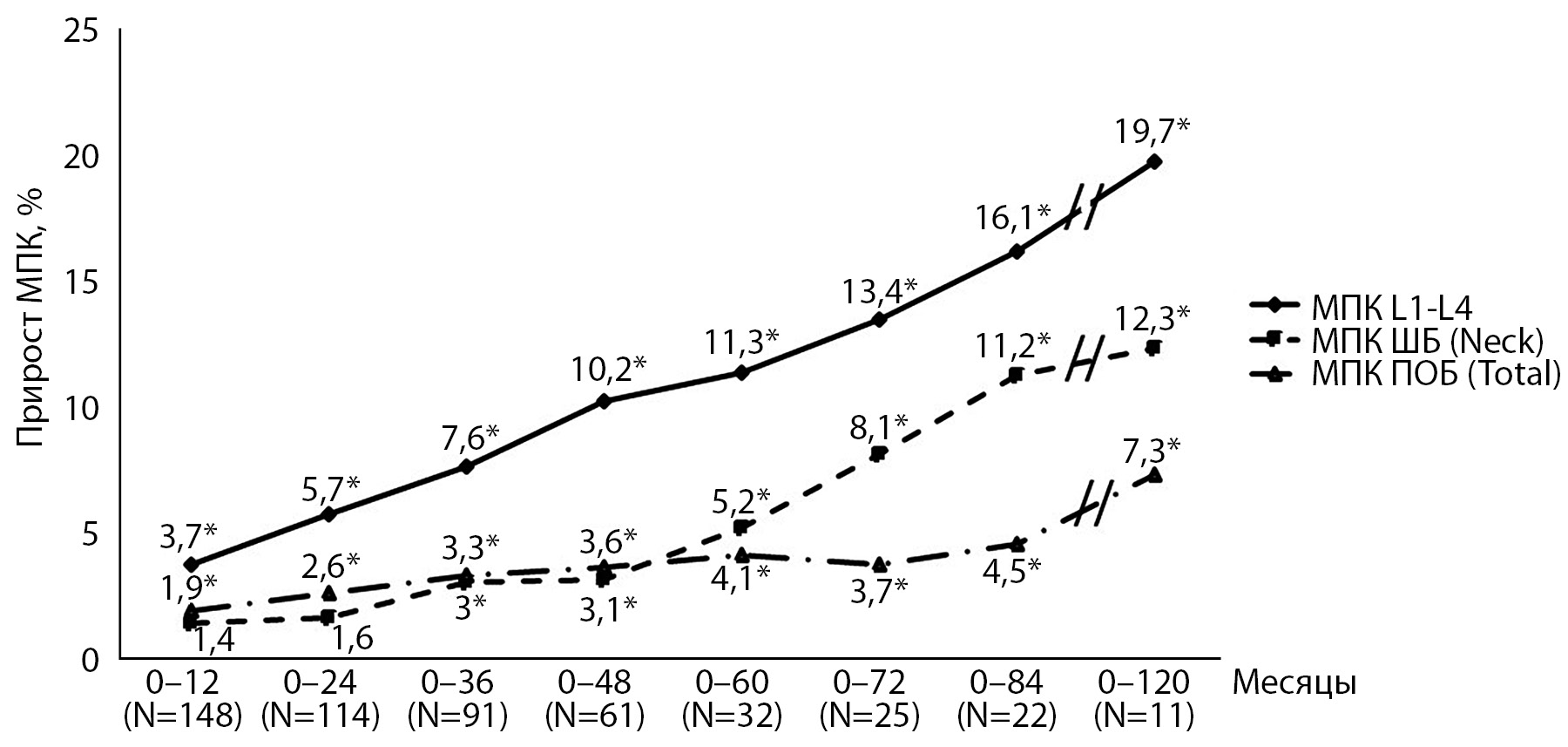
Рис. 1. Динамика МПК за период наблюдения.
Примечание: * – p<0,001 в сравнении с базовым измерением МПК.
У 11 пациенток, наиболее длительно принимавших терапию деносумабом (9,3 года), прирост МПК был максимальным и составил в позвоночнике 19,7%, в ШБ – 12,3%. Эти результаты согласуются с данными продленной фазы исследования FREEDOM, наблюдавшей 4550 пациенток, продолживших прием деносумаба в течение еще 7 лет после основного 3-х летнего лечения, где прирост МПК за 10 лет в позвоночнике составил 21,7%, в ШБ – 9,0% [1].
Прослежена динамика МПК у пациенток с подтвержденным ОП в отдельных участках скелета. По результатам DXA позвоночника, среди 148 человек, низкие значения МПК по Т-критерию (ниже -2,5 SD) выявлены у 120 человек, медиана Т-критерия составила -3,1 SD. За период наблюдения у 62 (54%) пациенток показатели МПК в позвоночнике достигли значений, соответствующих остеопении. У 58 пациентов МПК в позвоночнике сохранялась по Т-критерию ниже -2,5 SD. До начала лечения Т-критерий у них для области позвоночника был более низким, чем у пациенток, достигших остеопении, его медиана составила -3,9 SD и повысилась через 36 месяцев до -3,5 SD. Повышение МПК у этой категории пациентов было достоверным и расценивалось как положительная динамика, несмотря на отсутствие перехода в зону остеопении. У 69 пациенток были выявлены низкие значения МПК по Т-критерию (ниже -2,5 SD) в ШБ. За весь период наблюдения 30 (43,4%) женщин достигли целевых значений МПК в ШБ (Т-критерий -2,0 SD и выше).
Также были проанализированы изменения МПК у пациенток, принимавших и не принимавших АТ (табл. 2). До начала лечения деносумабом показатели МПК по Т-критерию как в позвоночнике, так и в ШБ в обеих группах не различались.
Таблица 2. Динамика МПК у пациенток, принимавших и не принимавших препараты для лечения ОП до назначения деносумаба.
Период | L1-L4 | Neck (шейка бедра) | ||||||
1 группа | 2 группа | p | 1 группа | 2 группа | p | |||
T-Критерий, SD | n | Т-критерий, SD | n | Т-критерий, SD | Т-критерий, SD | |||
0 | -3,10 | 97 | -3,2 | 51 | 0,27 | -2,28 | -2,44 | 0,14 |
12 | -2,79 | 97 | -3,0 | 51 | 0,22 | -2,16 | -2,35 | 0,05 |
24 | -2,61 | 77 | -2,77 | 37 | 0,32 | -2,06 | -2,27 | 0,05 |
36 | -2,59 | 65 | -2,63 | 26 | 0,41 | -2,01 | -2,21 | 0,14 |
48 | -2,66 | 39 | -2,55 | 22 | 0,15 | -2,14 | -2,22 | 0,57 |
60 | -2,38 | 22 | -2,46 | 10 | 0,21 | -2,02 | -2,11 | 0,55 |
72 | -2,24 | 17 | -2,32 | 8 | 0,23 | -2,08 | -1,91 | 0,26 |
84-96 | -2,22 | 14 | -2,30 | 8 | 0,56 | -1,82 | -1,81 | 0,17 |
Динамика СТх на фоне лечения деносумабом у пациенток, не принимавших и принимавших АТ, представлена на рисунке 2. Через 6 месяцев после начала терапии деносумабом наблюдалось выраженное снижение этого показателя на 48% (р<0,001) как у не принимавших, так и у принимавших ранее препараты для лечения ОП, а через 12 месяцев – на 67% (р<0,001) у не принимавших и на 58% (р<0,001) у получавших ранее АТ. Различий между группами не выявлено.
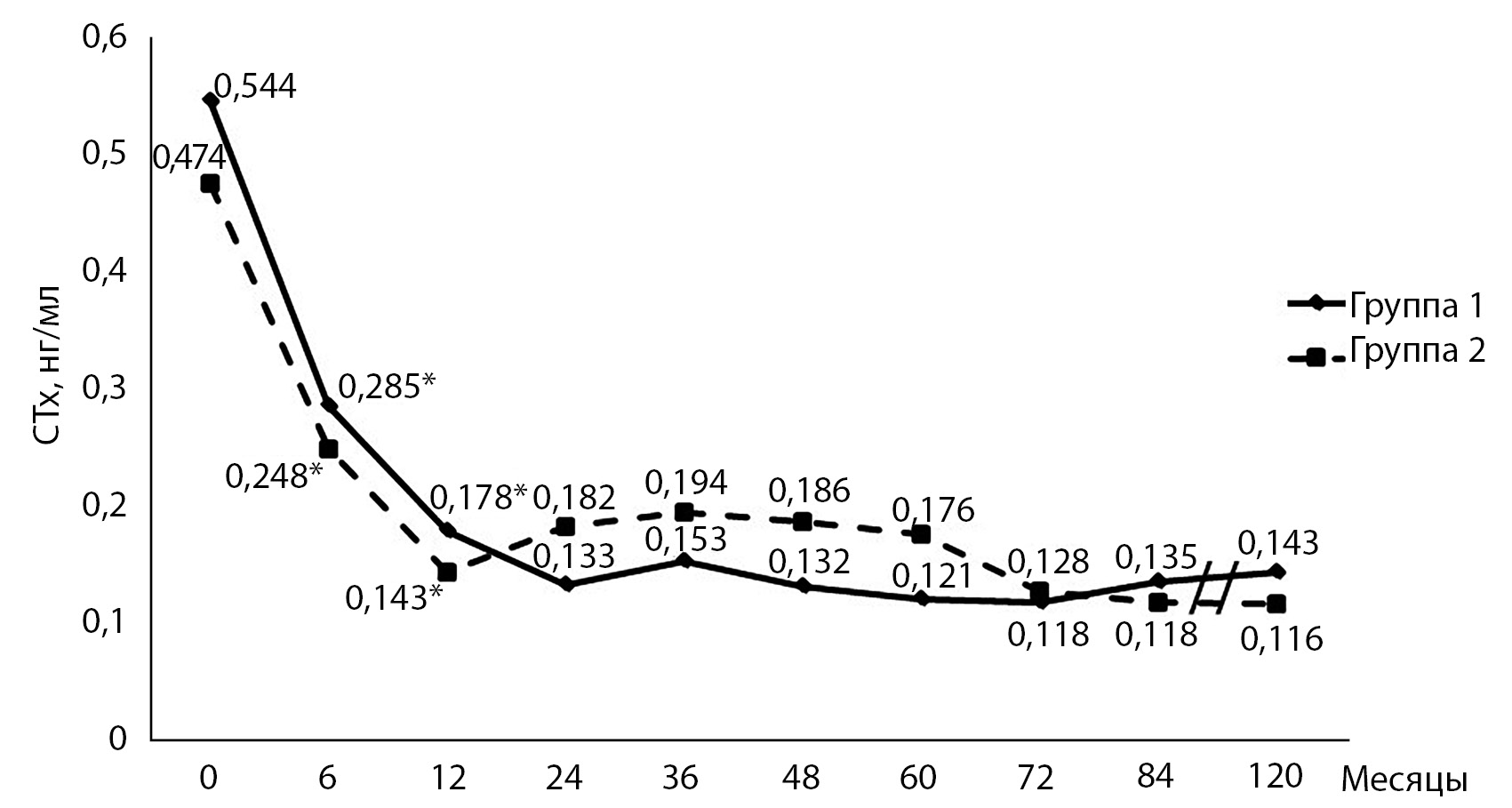
Рис. 2. Динамика СТх у пациенток, не принимавших и принимавших антиостеопорозную терапию до начала лечения деносумабом.
Примечание: * – р<0,001 между значениями CTx внутри группы.
У всех пациенток уровни общего кальция, общей щелочной фосфатазы и креатинина на момент включения в исследование находились в пределах референсных значений, за период наблюдения клинически значимых достоверных изменений этих показателей не наблюдалось.
За период наблюдения рентгенологически подтверждённые переломы позвонков были выявлены у 3-х пациенток в первые четыре месяца терапии. Следует отметить, что у этих пациенток наблюдались очень низкие значения МПК в позвоночнике и Т-критерий у них составил -3,7, -4,9, -5,0 SD. У одной пациентки произошел перелом лучевой кости, также в первый год терапии. Переломов ШБ и других периферических переломов зарегистрировано не было. В другом исследовании, где оценивалось применение деносумаба в реальной клинической практике, было отмечено, что статистически значимое снижение частоты переломов на фоне терапии деносумабом (на 51%; 95% ДИ 42-59%) наблюдалось к концу 12 месяцев терапии, по сравнению с первыми тремя месяцами после её начала [15].
Переносимость терапии деносумабом была хорошая, не было зарегистрировано отмены препарата по причине нежелательных явлений. Результаты данного исследования согласовывались с исследованием Рожинской Л.Я. и соавт., в котором безопасность лечения деносумабом наряду со значимым повышением МПК в позвоночнике, ПОБ и лучевой кости была продемонстрирована у пациенток с постменопаузальным, глюкокортикоидным ОП и снижением костной массы на фоне первичного гиперпаратиреоза [16].
По данным проведенных РКИ, выявлено, что у тех пациенток, которым после отмены деносумаба не была назначена терапия БФ, отмечается потеря МПК уже в течение первого года. Так, в исследовании рost-FREEDOM потеря МПК в позвоночнике у таких пациенток составила 8,1%, в ШБ – 6 %, в бедре в целом – 8,4%, а в среднем в течение первого года после прекращения терапии потеря МПК во всех участках скелета составляла 5–11% [17]. А в РКИ II фазы с участием 674 женщин, отмена деносумаба после 4-х летнего приёма, на фоне которого наблюдалось увеличение МПК поясничного отдела позвоночника с 9,4% до 11,8%, бедра с 4,0% до 6,1%, привела к снижению МПК на 6,6% в поясничном отделе позвоночника и на 5,3% в ПОБ также в течение первых 12 месяцев после прекращения лечения. При возобновлении терапии деносумабом МПК поясничного отдела позвоночника вновь увеличилась на 9,0%. Изменения МПК сопровождались соответствующей динамикой концентрации костных маркеров в крови: повышением их на фоне отмены препарата и снижением при возобновлении терапии [9].
В нашем исследовании 4 пациентки, получавшие деносумаб в течение 3-х лет и достигшие целевых значений МПК в ШБ (Т-критерий ≥-2 SD), для закрепления полученного эффекта принимали алендронат 70 мг в неделю в течение 3-6 месяцев и отменили самостоятельно из-за появления нежелательных эффектов со стороны ЖКТ (изжога, боль в эпигастрии, эрозивный гастрит). Пациенты также прекратили прием кальция и витамина D. При повторной денситометрии через год после отмены деносумаба потеря МПК в позвоночнике составила 4,4-8,2%, что послужило причиной возобновления терапии деносумабом, на фоне которой через 12 месяцев у всех пациенток наблюдалось увеличение МПК в позвоночнике на 4,3-6,8%.
У 5 пациенток после достижения целевых значений МПК в ШБ и дальнейшем назначении инфузии Акласты через 6 месяцев +65 дней, спустя год после введения препарата отмечалось недостоверное снижение МПК на 2,5% в позвоночнике и на 1% в ШБ, переломов не зафиксировано. Пациенты находятся под наблюдением и продолжают принимать кальций и витамин D в поддерживающих дозах.
Динамика МПК также была прослежена у 6 пациенток, которые отменили введение деносумаба после 2-4 инъекций по разным причинам, в том числе связанным с заболеванием новой коронавирусной инфекцией. Пациенты продолжали принимать препараты кальция и витамина D. При измерении МПК через 16-18 месяцев после последней инъекции отмечалось снижение костной массы на 4-8,5% в позвоночнике и на 1,5-2% в ШБ. У 1 пациентки произошел перелом позвонка при падении с высоты своего роста.
Таким образом, в результате проведенного анализа длительной терапии деносумабом у женщин в постменопаузе можно сделать следующие выводы:
У пациентов с различными сопутствующими заболеваниями, способствующими снижению костной массы или не влияющими на нее, отмечался значимый прирост МПК в позвоночнике и ПОБ, а также снижение маркера костной резорбции СТх, что отражает выраженный антирезорбтивный эффект препарата.
В течение длительного периода введения препарата (максимально допустимого) не было отмечено нежелательных эффектов, повлекших отмену препарата.
Сравнение групп пациентов, получающих и не получающих антиостеопорозную терапию до назначения деносумаба, не выявило различий в динамике МПК, маркера костной резорбции СТх и переносимости препарата.
Единичные случаи отмены препарата не позволили провести полноценную статистическую обработку и показать частоту новых переломов, однако был подтвержден эффект отмены препарата, заключающийся в быстром снижении МПК и повышении СТх.
Назначение БФ после отмены деносумаба не сохраняло МПК на достигнутом уровне, но снижало скорость потерь костной массы.
ЗАКЛЮЧЕНИЕ
Опыт применения деносумаба в амбулаторной практике подтвердил высокую эффективность и хорошую переносимость длительного применения препарата у пациенток с ОП различного генеза. Терапия деносумабом эффективно повышала МПК в обследованных участках скелета как у нелеченых пациенток, так и у тех, кто ранее получал АТ. Выраженное снижением уровня СTx свидетельствует о мощной антирезорбтивной активности препарата. Однако, учитывая механизм действия деносумаба, пациент должен быть проинформирован о риске возникновения «синдрома рикошета» при нарушении режима лечения и самостоятельной отмене препарата. При необходимости прекращения терапии деносумабом пациент обязательно должен проконсультироваться с врачом и обсудить возможные варианты дальнейшей тактики ведения.
Ограничения исследования
Небольшое число женщин, прослеженных после прекращения лечения деносумабом, не позволило статистически обосновано оценить эффекты отмены препарата и поэтому этот фрагмент носит описательный характер.
Направления дальнейших исследований
Перспективы дальнейшего развития темы заключаются в наблюдении за пациентами, которые прекратили терапию деносумабом, и оценке динамики МПК и переломов в разные сроки после отмены препарата.
Список литературы
1. Bone HG, Wagman RB, Brandi ML, et al. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol. 2017;5(7):513-523. https://doi.org/10.1016/S2213-8587(17)30138-9
2. Wu J, Zhang Q, Yan G, et al. Denosumab compared to bisphosphonates to treat postmenopausal osteoporosis: a meta-analysis. J Orthop Sur and Res. 2018;13(1):194. https://doi.org/10.1186/s13018-018-0865-3
3. Tsourd E, Zillikens MC. Certainties and Uncertainties About Denosumab Discontinuation. Calcif Tissue Int. 2018;103(1):1-4. https://doi.org/10.1007/s00223-018-0436-y
4. Brown JP, Dempster DW, Ding B, et al. Bone remodeling in postmenopausal women who discontinued denosumab treatment: Off-treatment biopsy study. J Bone Miner Res. 2011;26(11):2737-2744. https://doi.org/10.1002/jbmr.448
5. Anastasilakis AD, Makras P. Multiple clinical vertebral fractures following denosumab discontinuation. Osteoporos Int. 2016; 27(5):1929-1930. https://doi.org/10.1007/s00198-015-3459-5
6. Block GA, Bone HG, Fang L, et al. A single-dose study of denosumab in patients with various degrees of renal impairment. J Bone Miner Res. 2012;27(7):1471-1479. https://doi.org/10.1002/jbmr.1613
7. Bolognese MA, Teglbjærg CS, Zanchetta JR, et al. Denosumab significantly increases DXA BMD at both trabecular and cortical sites: results from the FREEDOM study. J Clin Densitom. 2013;16(2):147-153. https://doi.org/10.1016/j.jocd.2012.02.006
8. Muschitz C, Fahrleitner-Pammer A, Huber J, et al. Update on denosumab in postmenopausal osteoporosis—recent clinical data. Wien Med Wochenschr. 2012;162(17-18):374-379. https://doi.org/10.1007/s10354-012-0116-x
9. Kendler DL, Roux C, Benhamou CL, et al. Effects of denosumab on bone mineral density and bone turnover in postmenopausal women transitioning from alendronate therapy. J Bone Miner Res. 2010;25(1):72-81. https://doi.org/10.1359/jbmr.090716
10. Miller PD, Bolognese MA, Lewiecki EM, et al. Amg Bone Loss Study Group. Effect of denosumab on bone density and turnover inpostmenopausal women with low bone massafter long-term continued, discontinued, and restarting of therapy: a randomized blinded phase 2 clinical trial. Bone. 2008;43(2):222-229. https://doi.org/10.1016/j.bone.2008.04.007
11. Tsourdi E, Langdahl B, Cohen-Solal, et al. Discontinuation of Denosumab therapy for osteoporosis: A systematic review and position statement by ECTS. Bone. 2017;105:11-17. https://doi.org/10.1016/j.bone.2017.08.003
12. Белая Ж.Е., Bilezikian J.P., Ершова О.Б., и др. Возможности длительной терапии постменопаузального остеопороза: обзор результатов исследований деносумаба и резолюция совета экспертов российской ассоциации по остеопорозу (РАОП) // Остеопороз и остеопатии. - 2018. - T. 21. - № 1. - C. 17-22. https://doi.org/10.14341/osteo9760
13. Рекомендации Российской ассоциации по остеопорозу. Профилактика, диагностика и лечение дефицита витамина D и кальция среди взрослого населения и у пациентов с остеопорозом. M.: ГЭОТАР-Медиа, 2016.
14. Пигарова Е.А., Рожинская Л.Я., Белая Ж.Е., и др. Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых // Проблемы Эндокринологии. - 2016. - Т. 62. № 4. - С. 60-84. https://doi.org/10.14341/probl201662460-84
15. Yusuf АА, Cummings SR, Nelson B, et al. Real-world effectiveness of osteoporosis therapies for fracture reduction in postmenopausal women. Arch of Osteoporos. 2018;13(1):32-42. https://doi.org/10.1007/s11657-018-0439-3
16. Рожинская Л.Я., Гронская С.А., Мамедова Е.О., и др. Применение деносумаба для лечения остеопороза различного генеза в клинической практике // Остеопороз и остеопатии. 2020. - Т. 23. - №1. - С. 4-13. https://doi.org/10.14341/osteo12415
17. Zanchetta MB, Boailchuk J, Massari F, et al. Significant bone loss after stopping long-term denosumab treatment: a post FREEDOM study. Osteoporos Int. 2018;29(1):41-47. https://doi.org/10.1007/s00198-017-4242-6
Об авторах
И. А. СкрипниковаРоссия
Скрипникова Ирина Анатольевна, д.м.н. ResearcherID: O-4772-2016; Scopus Author ID: 6602554529; eLibrary SPIN: 1514-0880
101990, Москва, Петроверигский переулок, д. 10, стр. 3
О. В. Косматова
Россия
Косматова Ольга Владимировна, к.м.н. ResearcherID: K-2592-2017; Scopus Author ID: 57201131523; eLibrary SPIN: 5320-1904
Москва
В. Е. Новиков
Россия
Новиков Валерий Евгеньевич, к.м.н. ResearcherID: K-3329-2017; Scopus Author ID: 7402005343; eLibrary SPIN: 9994-2964
Москва
М. А. Мягкова
Россия
Мягкова Маргарита Анатольевна, к.м.н. ResearcherID: J-8778-2017; Scopus Author ID: 57201077315; eLibrary SPIN: 6588-8034
Москва
В. Н. Шишкова
Россия
Шишкова Вероника Николаевна, д.м.н. ResearcherID: AAJ-2413-2021; Scopus Author ID: 25932318700; eLibrary SPIN: 8507-5980
Москва
Дополнительные файлы
|
|
1. Рис. 1. Динамика МПК за период наблюдения. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(162KB)
|
Метаданные ▾ | |
|
|
2. Рис. 2. Динамика СТх у пациенток, не принимавших и принимавших антиостеопорозную терапию до начала лечения деносумабом. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(137KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Скрипникова И.А., Косматова О.В., Новиков В.Е., Мягкова М.А., Шишкова В.Н. Опыт длительного применения деносумаба у женщин с остеопорозом и различными сопутствующими заболеваниями. Остеопороз и остеопатии. 2021;24(2):48-55. https://doi.org/10.14341/osteo12922
For citation:
Skripnikova I.A., Kosmatova O.V., Novikov V.E., Myagkova M.A., Shishkova V.N. Experience of long-term use of denosumab in women with osteoporosis and various concomitant diseases. Osteoporosis and Bone Diseases. 2021;24(2):48-55. (In Russ.) https://doi.org/10.14341/osteo12922

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































