Перейти к:
Особенности течения пахидермопериостоза с верифицированной мутацией в гене европейского типа
https://doi.org/10.14341/osteo13136
Аннотация
Пахидермопериостоз (первичная гипертрофическая остеоартропатия) — орфанное заболевание, к основным клиническим проявлениям которого относятся булавовидная деформация пальцев по типу «барабанных палочек», периостоз (невоспалительные изменения надкостницы) трубчатых костей, пахидермия лица (гипертрофия и гиперплазия всех слоев кожи). К настоящему времени известны два гена, ассоциированных с развитием пахидермопериостоза, — HPGD и SLCO2A1. Мутации в данных генах приводят к нарушению метаболизма простагландина E2. В статье приводится описание клинического случая пациентки с пахидермопериостозом, у которой при проведении молекулярно-генетического исследования выявлены две мутации в гене HPGD: в 1 (chr4-174522451-T-A, NM_000860.6:c.1A>T) и во 2 (chr4-174521985-AG-, NM_000860.6:c.175_176del) экзонах в компаунд-гетерозиготном состоянии, при этом мутация c.1A>T ранее была однократно описана, а выявленное биаллельное сочетание мутаций в гене HPGD ранее в литературе не встречалось. Представленный клинический случай пахидермопериостоза — второй из описываемых в российской популяции и первый с подтвержденными мутациями в гене HPGD. Статья расширяет знания об ассоциации между генотипом и фенотипом при пахидермопериостозе, что способствует более быстрой и правильной интерпретации генетической информации при проведении генетического консультирования.
Ключевые слова
Для цитирования:
Фролова Т.М., Голоунина О.О., Мамедова Е.О., Литвинова Е.Е., Белая Ж.Е. Особенности течения пахидермопериостоза с верифицированной мутацией в гене европейского типа. Остеопороз и остеопатии. 2023;26(2):21-27. https://doi.org/10.14341/osteo13136
For citation:
Frolova T.M., Golounina O.O., Mamedova E.O., Litvinova E.E., Belaya Zh.E. Features of the clinical course of pachydermoperiostosis with a verified mutation in the European type gene. Osteoporosis and Bone Diseases. 2023;26(2):21-27. (In Russ.) https://doi.org/10.14341/osteo13136
АКТУАЛЬНОСТЬ
Пахидермопериостоз, или первичная гипертрофическая остеоартропатия, — орфанное заболевание, к основным клиническим проявлениям которого относятся деформация дистальных фаланг по типу «барабанных палочек», невоспалительные изменения надкостницы трубчатых костей (периостоз), гипертрофия и гиперплазия всех слоев кожи лица (пахидермия) [1]. Распространенность заболевания неизвестна, однако, по данным исследования Jajic I. и соавт. [2], она составляет 0,16%. В 95–97% случаев гипертрофическая остеоартропатия развивается у пациентов с тяжелыми заболеваниями, такими как злокачественное новообразование, порок сердца, цирроз печени и др. [3][4]. Таким образом, у любого пациента с подозрением на пахидермопериостоз первоначально следует исключить вторичные причины гипертрофической остеоартропатии. Согласно литературным данным, пахидермопериостоз в 7 раз чаще встречается у мужчин и, как правило, протекает тяжелее [5].
Первичная гипертрофическая остеоартропатия — гетерогенное заболевание. В 2008 г. Uppal S. и соавт. [4] определили, что гомозиготные мутации в гене HPGD (4q33-q34), кодирующем 15-гидроксипростагландиндегидрогеназу (15-PGDH), основной фермент деградации простагландинов, вызывают первичную гипертрофическую остеоартропатию 1 типа с аутосомно-рецессивным типом наследования (ОМIM 259100). В 2012 г. Zhang Z. и соавт. [6] выявили, что биаллельные мутации в гене SLCO2A1, кодирующем трансмембранный транспортер простагландинов (prostaglandin transporter, PGT), также приводят к развитию первичной гипертрофической остеоартропатии 2 типа с аутосомно-рецессивным типом наследования (ОMIM 614441). В более поздних исследованиях ученые доказали, что первичная гипертрофическая остеоартропатия, обусловленная моноаллельными патогенными мутациями в гене SLCO2A1, имеет аутосомно-доминантный тип наследования с неполной пенетрантностью и варьирующей экспрессивностью (ОМIM 167100) [7][8]. В ходе вышеупомянутых ключевых исследований проиллюстрирован патогенез пахидермопериостоза: нарушение транспорта простагландина Е2 (ПГЕ2) через плазматическую мембрану, опосредованного PGT, либо дефицит его цитоплазматического окисления, индуцированного 15-PGDH. Оба патогенных механизма приводят к повышению уровня циркулирующего ПГЕ2.
Комбинация клинических симптомов и степень их выраженности различны и могут варьировать. Touraine A. и соавт. в 1935 г. классифицировали пахидермопериостоз по фенотипу на несколько форм: полная форма с выраженным фенотипом, включающим периостоз и пахидермию; неполная форма с изолированным поражением костей и ограниченными изменениями кожи; форма изолированной пахидермии с минимальным или отсутствующим периостозом [9].
На сегодняшний день выделяют различные комбинации клинических симптомов, в том числе изолированное поражение дистальных фаланг (ОМIM 119900) [10][11]. Помимо триады главных симптомов, у пациентов нередко встречаются и другие проявления заболевания, такие как артриты (20–40%), гипергидроз (85%), повышенная жирность кожи (80%), себорея (50%), акроостеолиз (25%), гипертрофическая гастропатия, хроническая энтеропатия [11][12].
Необходимо отметить, что имеются некоторые географические особенности распространенности пахидермопериостоза: мутации в гене HPGD чаще встречаются в европейской популяции, тогда как мутации в гене SLCO2A1 — в азиатской [4][6][13]. Ранее на территории Российской Федерации зарегистрирован и описан всего один случай первичной гипертрофической остеоартропатии («азиатский вариант», первичная гипертрофическая остеоартропатия 2 типа) [14].
В данной статье представлен клинический случай пахидермопериостоза с подтвержденной мутацией в гене HPGD у пациентки, проживающей в Азиатской части России («европейский вариант», первичная гипертрофическая остеоартропатия 1 типа).
ОПИСАНИЕ СЛУЧАЯ
Пациентка Х., 21 год, впервые обратилась в ГНЦ РФ «ФГБУ НМИЦ эндокринологии» Минздрава России с жалобами на боли в суставах, повышенную влажность стоп. Из анамнеза известно, что в неонатальном периоде пациентке проведена операция по закрытию Боталлова протока. В раннем детском возрасте манифестировала деформация пальцев рук и ногтевых пластин. Со временем присоединились жалобы на припухлость, ограничение подвижности и утреннюю скованность, преимущественно в симметричных суставах: коленных, голеностопных, лучезапястных. «Рассвет» клинической симптоматики пришелся на подростковый возраст, когда вышеперечисленные жалобы стали беспокоить практически ежедневно. Пациентка состояла на диспансерном учете у ортопеда и ревматолога, к назначаемой терапии наблюдалась резистентность, однако симптомы купировались приемом нестероидных противовоспалительных средств (НПВС). В возрасте 14 лет пациентка госпитализирована в хирургическое отделение по месту жительства в связи с развившимся гемартрозом левого коленного сустава. Со временем наблюдалось некоторое смягчение клинической картины заболевания, частота приема НПВС заметно снизилась.
В возрасте 13 лет проведено молекулярно-генетическое исследование, идентифицированы два патогенных варианта в гене HPGD: в 1 (chr4-174522451-T-A, NM_000860.6:c.1A>T) и во 2 (chr4-174521985-AG-, NM_000860.6:c.175_176del) экзонах в компаунд-гетерозиготном состоянии, на основании чего установлен диагноз «пахидермопериостоз».
По данным объективного осмотра при поступлении обращало на себя внимание марфаноподобное телосложение (высокий рост, длинные конечности, укрупненные ладони, стопы, удлиненные ключицы), варусная установка обоих коленных суставов, грубые черты лица, отмечалась булавовидная деформация концевых фаланг кистей и стоп, деформация ногтевых пластин в виде «часовых стекол», на коже стоп — незначительный гиперкератоз (рис. 1, 2). Однако признаков гипертрофии и гиперплазии кожи лица не наблюдалось.
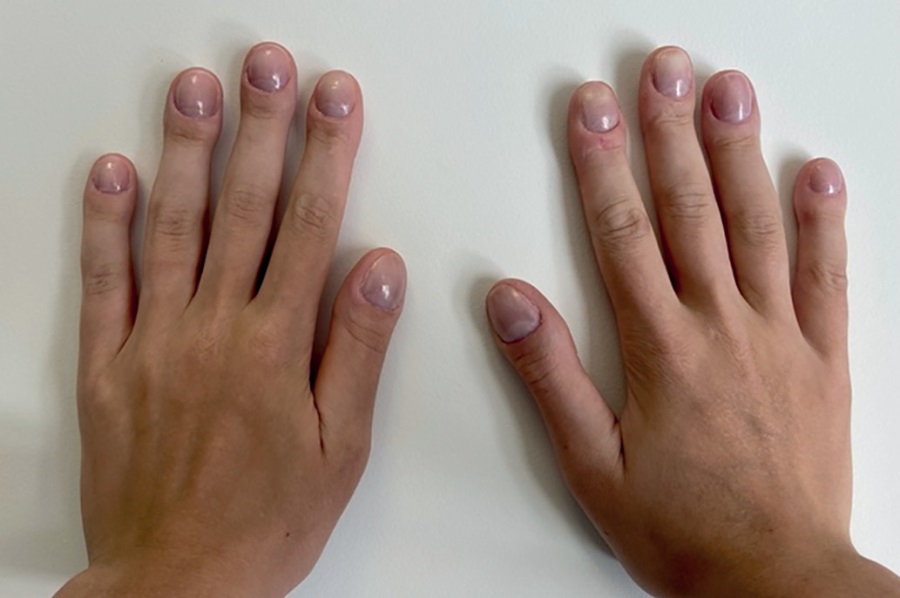
Рисунок 1. Внешний вид кистей рук пациентки Х.
Примечание. Изменение дистальных фаланг пальцев рук
по типу «барабанных палочек» и ногтей по типу «часовых стекол».
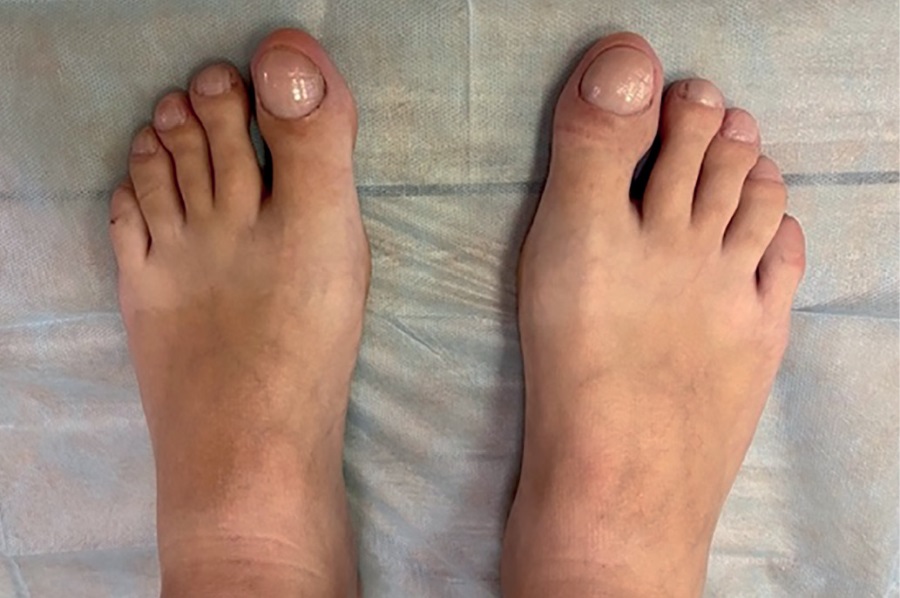
Рисунок 2. Внешний вид стоп пациентки с пахидермопериостозом.
При обследовании лабораторно определялись повышение скорости оседания эритроцитов до 38 мм/ч и С-реактивного белка до 11 мг/л, повышение маркера костной резорбции С-концевого телопептида коллагена 1 типа до 0,719 нг/мл, остальные результаты представлены в таблице 1. В связи с выраженным суставным синдромом, укрупнением конечностей, увеличением толщины мягких тканей стопы определен уровень инсулиноподобного ростового фактора 1, что позволило исключить акромегалию.
Таблица 1. Данные лабораторных исследований
пациентки Х. при первичном обращении
в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России
|
Параметр |
Значение |
Референсный интервал |
|
Кальций общий, ммоль/л |
2,34 |
2,15–2,55 |
|
Кальций ионизированный, ммоль/л |
1,07 |
1,03–1,29 |
|
Альбумин, г/л |
40,6 |
35–50 |
|
Фосфор, ммоль/л |
1,16 |
0,74–1,52 |
|
Щелочная фосфатаза, Ед/л |
44 |
40–150 |
|
Инсулиноподобный фактор роста 1, нг/мл |
188,6 |
102–351 |
|
Тиреотропный гормон, мМЕ/л |
0,709 |
0,25–3,5 |
|
Остеокальцин, нг/мл |
41,81 |
11–43 |
|
С-концевой телопептид коллагена 1 типа, нг/мл |
0,719 |
0,3–0,57 |
|
С-реактивный белок, мг/л |
11 |
0,1–5 |
|
Ревматоидный фактор, МЕ/мл |
10 |
0–30 |
|
Скорость оседания эритроцитов, мм/ч |
38 |
2–20 |
По данным рентгеновской остеоденситометрии с оценкой трабекулярного костного индекса показатели в пределах нормальных значений.
По результатам рентгенографии кистей рук отмечены гипертрофия эпифизов ногтевых фаланг, акроостеолиз, гиперпериостоз диафизов пястных костей и костей предплечья (рис. 3). При проведении рентгенографии коленного сустава выявлены выраженный периостоз диафизов бедренных костей (толщина надкостницы 0,98 cм), средневыраженный периостоз диафизов большеберцовых костей, утолщение внутреннего кортикального слоя надколенника до 0,41 см (рис. 4). По данным рентгенографии голеностопного сустава также отмечаются средневыраженный периостоз, повышение плотности кортикального слоя, гипертрофия пяточного бугра, повышение толщины мягких тканей стопы до 2,72 см слева, гипертрофия задней малоберцовой мышцы, утолщение периоста в нижней трети диафиза малоберцовой кости до 0,85 мм справа и до 0,77 мм слева (рис. 4).
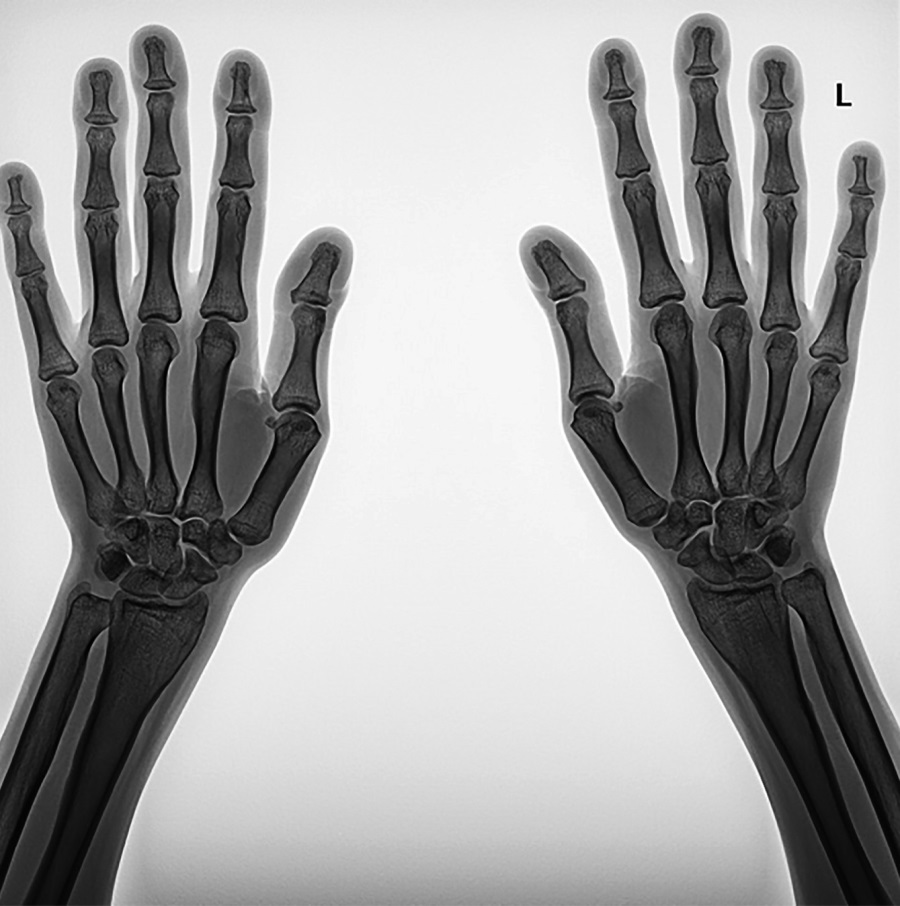
Рисунок 3. Рентгенография кистей рук пациентки Х.
Примечание. Гипертрофия эпифизов ногтевых фаланг, акроостеолиз,
гиперпериостоз диафизов пястных костей и костей предплечья.
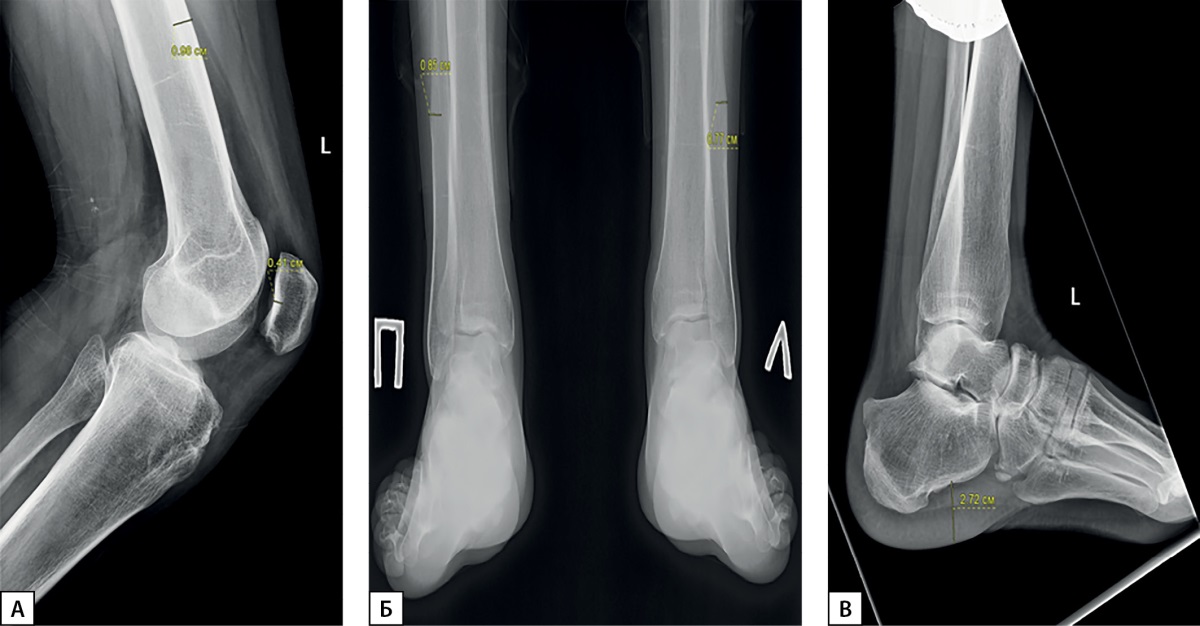
Рисунок 4. Рентгенография коленного и голеностопного суставов.
Примечание. А — рентгенография левого коленного сустава.
Выраженный периостоз диафизов бедренных костей,
средневыраженный периостоз диафизов большеберцовых костей,
утолщение внутреннего кортикального слоя надколенника;
Б — рентгенография голеностопных суставов (вид сзади);
В — рентгенография голеностопного сустава (боковая проекция).
Средневыраженный периостоз, повышение плотности кортикального слоя,
гипертрофия пяточного бугра, утолщение мягких тканей стопы,
гипертрофия задней малоберцовой мышцы,
утолщение периоста в нижней трети диафиза малоберцовой кости.
Для уменьшения выраженности суставного синдрома пациентке рекомендован прием селективных ингибиторов циклооксигеназы(ЦОГ)-2.
ОБСУЖДЕНИЕ
Первичную гипертрофическую остеоартропатию относительно легко диагностировать, если присутствует триада главных симптомов. Особенностью представленного нами клинического случая явилось наличие у пациентки изменений фаланг пальцев и ногтевых пластин, а также наличие периостоза и изолированного акроостеолиза, однако отсутствовали клинические признаки пахидермии. Таким образом, доминирование ревматологических проявлений заболевания может обуславливать определенные трудности верификации диагноза, отмеченные также рядом других авторов [9][15]. Несмотря на то что артралгия и артрит присутствуют у 20–40% пациентов с пахидермопериостозом, массивный суставной выпот с дисфункцией сустава встречается редко [12][16][17]. Таким образом, наличие в анамнезе гемартроза является еще одной особенностью представленного нами клинического случая и непосредственно вносит свой вклад в тяжесть течения заболевания.
Артралгия при первичной гипертрофической остеоартропатии, как и при ювенильном идиопатическом артрите, имеет преимущественно симметричный характер, что повышает риск неверной установки диагноза [17]. В случае серонегативного артрита, резистентного к терапии базисными противоревматическими препаратами, необходимо исключать гипертрофическую остеоартропатию. НПВС, блокирующие синтез ПГЕ2, в данном случае являются патогенетической терапией. Предпочтение следует отдавать селективным блокаторам ЦОГ-2 в связи с высоким риском побочных эффектов неселективных блокаторов ЦОГ-1 и ЦОГ-2 [18]. Так, у пациентки Х. на фоне бесконтрольного применения неселективных НПВС манифестировали острые язвы желудка. Гастро- и энтеропатии при пахидермопериостозе встречаются, однако в большей степени характерны для пациентов с мутацией в гене SLCO2A1 [7][19][20]. Согласно недавнему исследованию, у пациентов женского пола с аутосомно-рецессивной мутацией в гене SLCO2A1 хроническая энтеропатия может развиваться изолированно, без сопутствующей клинической картины пахидермопериостоза [19].
В связи со схожей клинической картиной (выраженный суставной синдром, укрупнение конечностей), а также увеличением толщины мягких тканей стопы по данным рентгенографии дифференциальную диагностику также целесообразно проводить с акромегалией [21].
На сегодняшний день доказано, что клинические проявления заболевания зависят от степени повышения, а также от выраженности плейотропных эффектов ПГЕ2 в различных тканях. Стабильно повышенный уровень ПГЕ2 ассоциирован с вазодилатацией в дистальных отделах конечностей, способствуя их булавовидной деформации [12][22]. При чрезмерной стимуляции рецепторов ПГЕ2 (EP4) в костной ткани со временем развиваются периостоз и акроостеолиз: за счет повышения активности симпатической нервной системы активируются пролиферация и дифференцировка остеобластов и косвенно, через стимуляцию RANKL в остеобластных клетках, стимулируется дифференцировка остеокластов [8][23].
По данным некоторых исследований, терапия бисфосфонатами (золедроновой кислотой, памидроновой кислотой) может быть эффективна как при первичной, так и при вторичной гипертрофической остеоартропатии [24–26]. Помимо ингибирования резорбции костной ткани остеокластами бисфосфонаты обладают противовоспалительным действием, а также снижают уровень фактора роста эндотелия сосудов [27]. Кроме того, бисфосфонаты продемонстрировали многообещающие результаты у пациентов с ревматологическими проявлениями первичной гипертрофической остеоартропатии, а также при болях в костях в случае ревматоидного артрита, спондилоартрита [28]. Однако в связи с изолированным акроостеолизом, нормальными показателями минеральной плотности костной ткани, прямых показаний к назначению бисфосфонатов нашей пациентке на данный момент нет, рекомендовано наблюдение в динамике.
С целью определения ассоциации между генотипом и фенотипом, а также оценки эпидемиологических особенностей проанализирована база Medline. Вариант c.175_176delCT является мутацией горячей точки и приводит к сдвигу рамки считывания. По данным исследований, это самая распространенная мутация HPGD в семьях европеоидов, всего описано около 10 семей [4][22][29][30]. Клинические проявления варьируют от полной формы пахидермопериостоза до изолированного поражения дистальных фаланг. Патогенный вариант NM_000860.6:c.1A>T описан в одной семье: у троих детей, рожденных в близкородственном браке (географический регион — Турция). Данная мутация приводит к потере стартового кодона [31].
Таким образом, у нашей пациентки, проживающей в азиатской части России, по результатам генетического исследования выявлены патогенные варианты, характерные для европейской популяции пациентов с пахидермопериостозом. Генетическое исследование родителям пациентки не проводилось.
Согласно данным литературы, существует ассоциация между генотипом и фенотипом. В случае мутации в гене HPGD заболевание чаще манифестирует в раннем детском возрасте. В неонатальном периоде могут наблюдаться врожденный порок сердца (открытый артериальный проток), позднее закрытие родничков [4][32]. С течением времени, через 5–20 лет после манифестации, при мутациях в гене HPGD состояние пациентов нередко улучшается. Подобные особенности течения заболевания полностью коррелируют с представленным нами клиническим случаем.
В отличие от первичной гипертрофической остеоартропатии 1 типа с аутосомно-рецессивным типом наследования при мутациях в гене SLCO2A1 первые клинические признаки пахидермопериостоза манифестируют в подростковом или даже во взрослом возрасте, однако прогноз течения заболевания хуже [14]. В большинстве случаев со временем стабилизации состояния не наблюдается и тяжесть пахидермии и артрита становится выраженной [14]. В упомянутом выше исследовании Xu Y. и соавт. [8] показано, что при пахидермопериостозе с аутосомно-доминантным типом наследования в случае моноаллельной мутации в гене SLCO2A1 клиническая картина заболевания менее тяжелая, чем при первичной гипертрофической остеоартропатии 2 типа с аутосомно-рецессивным типом наследования.
ЗАКЛЮЧЕНИЕ
Диагностика пахидермопериостоза в большинстве случаев основывается на триаде клинических симптомов (пахидермия, периостоз, симптом «барабанных палочек») и исключении причин вторичной гипертрофической остеоартропатии. Однако диагноз следует заподозрить при наличии хотя бы одного классического критерия и направить пациента на прохождение генетического исследования. Результаты настоящей статьи расширяют знания об ассоциации между генотипом и фенотипом при пахидермопериостозе, что способствует более быстрой и правильной интерпретации генетической информации при проведении генетического консультирования.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Согласие пациента. Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Остеопороз и остеопатии».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Источник финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Список литературы
1. Castori M, Sinibaldi L, Mingarelli R, et al. Pachydermoperiostosis: an update. Clin Genet. 2005;68(6):477-486. doi: https://doi.org/10.1111/j.1399-0004.2005.00533.x
2. Jajic I, Jajic Z. Prevalence of primary hypertrophic osteoarthropathy in selected population. Clin Ex Rheum. 1992;(10):73
3. Lee S, Park SY, Kwon HJ, et al. Identification of the mutations in the prostaglandin transporter gene, SLCO2A1 and clinical characterization in Korean patients with pachydermoperiostosis. J Korean Med Sci. 2016;31(5):735-742. doi: https://doi.org/10.3346/jkms.2016.31.5.735
4. Uppal S, Diggle CP, Carr IM, et al. Mutations in 15-hydroxyprostaglandin dehydrogenase cause primary hypertrophic osteoarthropathy. Nat Genet. 2008;40(6):789-793. doi: https://doi.org/10.1038/ng.153
5. Abdullah NRA, Jason WLC, Nasruddin AB. Pachydermoperiostosis: a rare mimicker of acromegaly. Endocrinol Diabetes Metab Case Reports. 2017;2017. doi: https://doi.org/10.1530/EDM-17-0029
6. Zhang Z, Xia W, He J, et al. Exome sequencing identifies SLCO2A1 mutations as a cause of primary hypertrophic osteoarthropathy. Am J Hum Genet. 2012;90(1):125-132. doi: https://doi.org/10.1016/j.ajhg.2011.11.019
7. Zhang Z, He JW, Fu WZ, et al. Mutations in the SLCO2A1 gene and primary hypertrophic osteoarthropathy: a clinical and biochemical characterization. J Clin Endocrinol Metab. 2013;98(5):923-933. doi: https://doi.org/10.1210/jc.2012-3568.
8. Xu Y, Zhang Z, Yue H, et al. Monoallelic mutations in SLCO2A1 cause autosomal dominant primary hypertrophic osteoarthropathy. J Bone Miner Res. 2021;36(8):1459-1468. doi: https://doi.org/10.1002/jbmr.4310
9. Sinha GP, Curtis P, Haigh D, et al. Pachydermoperiostosis in childhood. Br J Rheumatol. 1997;36(11):1224-1227. doi: https://doi.org/10.1093/rheumatology/36.11.1224
10. Tariq M, Azeem Z, Ali G, et al. Mutation in the HPGD gene encoding NAD+ dependent 15-hydroxyprostaglandin dehydrogenase underlies isolated congenital nail clubbing (ICNC). J Med Genet. 2009;46(1):14-20. doi: https://doi.org/10.1136/jmg.2008.061234
11. Umair M, Bilal M, Shah K, et al. Homozygous missense variant in the Solute Carrier Organic Anion Transporter 2A1 (SLCO2A1) gene underlies isolated nail clubbing. Genes (Basel). 2023;14(2):430. doi: https://doi.org/10.3390/genes14020430
12. González LA, Quintero-González DC, Vanegas-García AL. Digital clubbing, joint pain, and skin changes in a young man: primary hypertrophic osteoarthropathy. Clin Rheumatol. 2022;41(10):3253-3255. doi: https://doi.org/10.1007/s10067-022-06244-6
13. Latos-Bielenska A, Marik I, Kuklik M, et al. Pachydermoperiostosis–critical analysis with report of five unusual cases. Eur J Pediatr. 2007;166(12):1237-1243. doi: https://doi.org/10.1007/s00431-006-0407-6
14. Фурсенко В.А., Гребенникова Т.А., Никитин А.Г., Белая Ж.Е. Пахидермопериостоз: особенности диагностики на примере клинического случая // Остеопороз и остеопатии. — 2017. — Т. 20. — №2. — С. 52-57. doi: https://doi.org/10.14341/osteo9354
15. Wójtowicz J, Kołodziejczyk B, Gazda A, Gietka P. Primary hypertrophic osteoarthropathy - a rare cause of pain and arthritis in children. Description of 5 cases. Cent Eur J Immunol. 2022;47(3):280-287. doi: https://doi.org/10.5114/ceji.2022.120171
16. Cooper RG, Freemont AJ, Riley M, et al. Bone abnormalities and severe arthritis in pachydermoperiostosis. Ann Rheum Dis. 1992;51(3):416-419. doi: https://doi.org/10.1136/ard.51.3.416.
17. Ibba S, Piga M, Congia M, et al. Pachidermoperiostosis as a cause of massive joint effusion with polyarticular involvement mimicking juvenile idiopathic arthritis: A case report. Joint Bone Spine. 2016;83(1):113-114. doi: https://doi.org/10.1016/j.jbspin.2015.03.001
18. Yuan L, Liao R, Lin Y, et al. Safety and efficacy of cyclooxygenase-2 inhibition for treatment of primary hypertrophic osteoarthropathy: A single-arm intervention trial. J Orthop Transl. 2019;(18):109-118. doi: https://doi.org/10.1016/j.jot.2018.10.001
19. Tsuzuki Y, Aoyagi R, Miyaguchi K, et al. Chronic Enteropathy Associated with SLCO2A1 with Pachydermoperiostosis. Intern Med. 2020;59(24):3147-3154. doi: https://doi.org/10.2169/internalmedicine.4756-20
20. Wang Q, Li YH, Lin GL, et al. Primary hypertrophic osteoarthropathy related gastrointestinal complication has distinctive clinical and pathological characteristics: two cases report and review of the literature. Orphanet J Rare Dis. 2019;14(1):297. doi: https://doi.org/10.1186/s13023-019-1264-5
21. Marques P, Korbonits M. Approach to the patient with pseudoacromegaly. J Clin Endocrinol Metab. 2022;107(6):1767-1788. doi: https://doi.org/10.1210/clinem/dgab789
22. Diggle CP, Carr IM, Zitt E, et al. Common and recurrent HPGD mutations in Caucasian individuals with primary hypertrophic osteoarthropathy. Rheumatology (Oxford). 2010;49(6):1056-1062. doi: https://doi.org/10.1093/rheumatology/keq048
23. Chen H, Hu B, Lv X, et al. Prostaglandin E2 mediates sensory nerve regulation of bone homeostasis. Nat Commun. 2019;10(1):181. doi: https://doi.org/10.1038/s41467-018-08097-7
24. Jagdish RK. Bisphosphonates use in a Case of Pachydermoperiostosis. Austin J Orthop Rheumatol. 2017;4(1):1046. doi: https://doi.org/10.26420/austinjorthopaderheumatol.2017.1046
25. Jagdish RK, Bhatnagar MK, Malhotra A, Aggarwal R, Shailly. Bisphosphonates use in Pachydermoperiostosis. J Assoc Physicians India. 2019;67(9):87-90
26. Sonthalia N, Mukherjee K, Saha A, Talukdar A. Treatment of hypertrophic osteoarthropathy in the case of pulmonary metastasis secondary-to-nasopharyngeal carcinoma with zoledronic acid: an enlightening experience. Case Reports. 2012;2012(1):bcr2012006759-bcr2012006759. doi: https://doi.org/10.1136/bcr-2012-006759
27. Голоунина О.О., Белая Ж.Е. Бисфосфонаты: 50 лет в медицинской практике // Consilium Medicum. — 2020. — Т. 22. — №4. — С. 66-73. doi: https://doi.org/10.26442/20751753.2020.4.200102
28. Karunasree N, Narasimha R. Management of Pachydermoperiostosis with Bisphosphonates, Isotretinoin and Colchicine-A Case Report. International Journal of Pharmacy and Biological Sciences. 2015;(5):18-23.
29. Seifert W, Beninde J, Hoffmann K, et al. HPGD mutations cause cranioosteoarthropathy but not autosomal dominant digital clubbing. Eur J Hum Genet. 2009;17(12):1570-1576. doi: https://doi.org/10.1038/ejhg.2009.104
30. Tüysüz, B., Yılmaz, S., Kasapçopur, Ö. et al. Primary hypertrophic osteoarthropathy caused by homozygous deletion in HPGD gene in a family: changing clinical and radiological findings with long-term follow-up. Rheumatol Int. 2014;34(11):1539-1544. doi: https://doi.org/10.1007/s00296-014-3037-8
31. Yüksel-Konuk B, Sırmacı A, Ayten GE, et al. Homozygous mutations in the 15-hydroxyprostaglandin dehydrogenase gene in patients with primary hypertrophic osteoarthropathy. Rheumatol Int. 2009;30(1):39-43. doi: https://doi.org/10.1007/s00296-009-0895-6
32. Radhakrishnan P, Jacob P, Nayak SS, et al. Digital clubbing as the predominant manifestation of hypertrophic osteoarthropathy caused by pathogenic variants in HPGD in three Indian families. Clin Dysmorphol. 2020;29(3):123-126. doi: https://doi.org/10.1097/MCD.0000000000000324
Об авторах
Т. М. ФроловаРоссия
Фролова Татьяна Михайловна - клинический ординатор.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
О. О. Голоунина
Россия
Голоунина Ольга Олеговна - студент.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Е. О. Мамедова
Россия
Мамедова Елизавета Октаевна – старший научный сотрудник отделения остеопороза и остеопатий, кандидат медицинских наук.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Е. Е. Литвинова
Россия
Литвинова Елена Евгеньевна - врач-рентгенолог.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна – заведующая отделением остеопороза и остеопатий, доктор медицинских наук, профессор.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Дополнительные файлы
|
|
1. Рисунок 1. Внешний вид кистей рук пациентки Х. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(104KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Внешний вид стоп пациентки с пахидермопериостозом. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(140KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Рентгенография кистей рук пациентки Х. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(245KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Рентгенография коленного и голеностопного суставов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(243KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Фролова Т.М., Голоунина О.О., Мамедова Е.О., Литвинова Е.Е., Белая Ж.Е. Особенности течения пахидермопериостоза с верифицированной мутацией в гене европейского типа. Остеопороз и остеопатии. 2023;26(2):21-27. https://doi.org/10.14341/osteo13136
For citation:
Frolova T.M., Golounina O.O., Mamedova E.O., Litvinova E.E., Belaya Zh.E. Features of the clinical course of pachydermoperiostosis with a verified mutation in the European type gene. Osteoporosis and Bone Diseases. 2023;26(2):21-27. (In Russ.) https://doi.org/10.14341/osteo13136

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































