Перейти к:
Роль кальций-чувствительного рецептора в регуляции синтеза паратиреоидного гормона в норме и при патологии
https://doi.org/10.14341/osteo13142
Аннотация
Паратиреоидный гормон (ПТГ) играет ключевую роль в поддержании фосфорно-кальциевого гомеостаза. Секреция ПТГ регулируется посредством кальций-чувствительного рецептора (КЧР), преимущественно располагающегося на поверхности клеток околощитовидных желез и почечных канальцев. Активация КЧР происходит при повышении уровня кальция в организме и направлена на ингибирование синтеза ПТГ и усиление экскреции кальция с мочой, т.е. на защиту организма от неблагоприятного воздействия гиперкальциемии. Снижение экспрессии и/или изменение работы КЧР приводит к нарушению регуляции синтеза ПТГ и лежит в основе развития таких заболеваний, как первичный и вторичный гиперпаратиреоз, а также в ряде наследственных заболеваний, связанных с нарушением кальциевого гомеостаза. В данной работе рассмотрены функции КЧР в норме, а также обсуждаются потенциальные механизмы нарушения чувствительности КЧР при различных патологиях.
Ключевые слова
Для цитирования:
Мармалюк Д.А., Рунова Г.Е., Фадеев В.В. Роль кальций-чувствительного рецептора в регуляции синтеза паратиреоидного гормона в норме и при патологии. Остеопороз и остеопатии. 2023;26(3):25-32. https://doi.org/10.14341/osteo13142
For citation:
Marmalyuk D.A., Runova G.E., Fadeyev V.V. The role of the calcium-sensing receptor in the regulation of parathyroid hormone secretion in physiology and in calcitropic diseases. Osteoporosis and Bone Diseases. 2023;26(3):25-32. (In Russ.) https://doi.org/10.14341/osteo13142
ВВЕДЕНИЕ
Паратиреоидный гормон (ПТГ) — это полипептидный гормон, синтезирующийся клетками околощитовидных желез (ОЩЖ). Главная роль ПТГ заключается в регуляции фосфорно-кальциевого обмена. Кальций и фосфор являются основными составляющими матрикса костной ткани. Однако, помимо костей, эти макроэлементы содержатся в крови, межклеточной жидкости и внутри клеток, где участвуют в таких физиологических процессах, как передача внутриклеточных сигналов, транскрипция генов и др.
В норме уровни ПТГ и кальция подчиняются механизму отрицательной обратной связи. Концентрация ионизированного кальция в крови является главным регулятором секреции ПТГ. Гипокальциемия увеличивает синтез ПТГ, действие которого направлено на мобилизацию кальция из костей, стимуляцию реабсорбции кальция в почках и на повышение абсорбции кальция в кишечнике, т.е. на увеличение уровня кальция в крови. Высокие концентрации кальция, наоборот, подавляют секрецию ПТГ. Регуляторное действие кальция реализуется посредством кальций-чувствительного рецептора (КЧР).
ОСНОВНЫЕ СВЕДЕНИЯ О КЧР
КЧР представляет собой димерный белок и является типичным представителем G-белок-связанных трансмембранных рецепторов и состоит из трех доменов: большого внеклеточного, трансмембранного и внутриклеточного (рис. 1). Внеклеточный домен представлен двумя протомерами, включающими в свой состав отрицательно заряженные аминокислотные остатки, за счет которых происходит связывание рецептора с его лигандами (ионами кальция и другими ионами, аминокислотами, кальцимиметиками). В неактивном состоянии эти два протомера разъединены, но связывание лиганда с внеклеточной частью рецептора вызывает конформацию всего рецептора, в результате чего оба участка домена соединяются и КЧР возбуждается. Трансмембранный домен состоит из 7 спиралей и связан с различными вторичными посредниками, активация которых приводит к каскаду внутриклеточных реакций, за счет которых и реализуются основные эффекты КЧР. Внутриклеточный домен состоит из аминокислот и ответственен за размещение рецептора на мембране клетки [1].
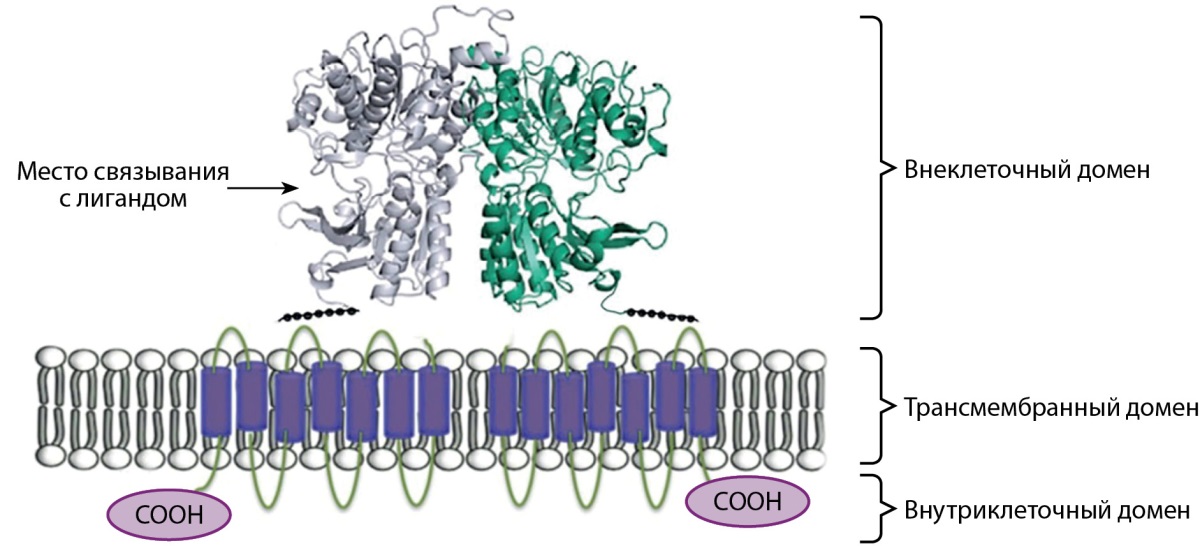
Рисунок 1. Схематическое строение кальций-чувствительного рецептора.
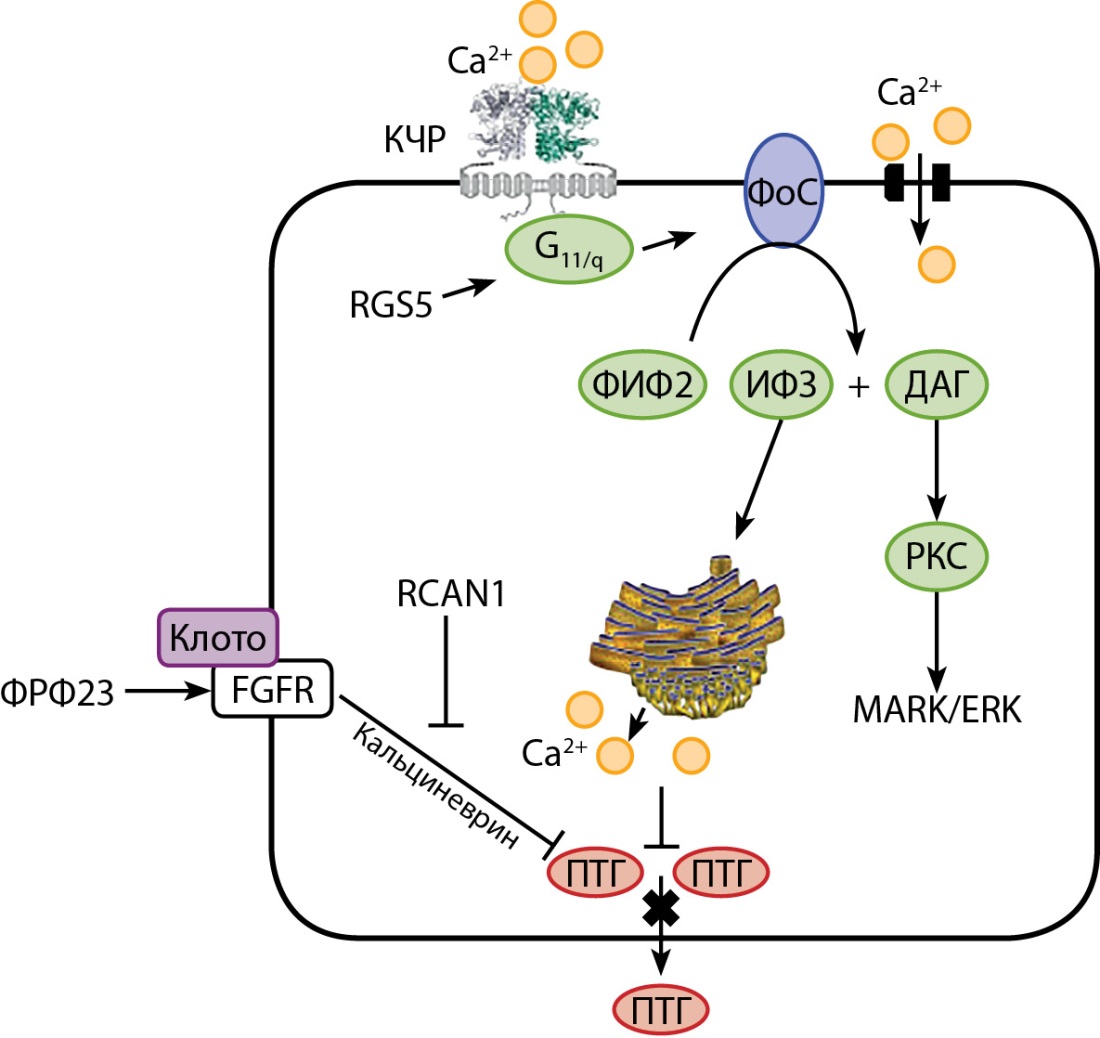
Рисунок 2. Сигнальные пути,
опосредованные активацией кальций-чувствительного рецептора,
в клетках околощитовидных желез.
Примечание. КЧР — кальций-чувствительный рецептор;
Ca2+ — ионы кальция; RGS5 — регулятор передачи сигналов G-белка 5;
G11/q — семейство G-белков; ФоС — фосфолипаза С;
ФИФ2 — фосфатидилинозитоладифосфат;
ИФ3 — инозитолтрифосфат; ДАГ — диацилглицерол;
РКС — протеинкиназа С; ФРФ23 — фактор роста фибробластов 23;
MAPK/ERK — один из видов сигнального пути МАРК;
FGFR — рецептор к ФРФ23; RCAN1 — регулятор кальциневрина 1;
ПТГ — паратиреоидный гормон.
Функционирование КЧР связано с активацией белка-Gq/11,
который регулирует дальнейшую работу вторичных посредников,
таких как ИФ3 и ДАГ. Действие ИФ3 направлено
на увеличение внутриклеточной концентрации кальция,
которая подавляет секрецию ПТГ.
ДАГ совместно с растущей концентрацией ионов кальция
в цитозоле клетки регулирует пролиферацию клеток ОЩЖ
через сигнальный путь МАРК/ERK.
КЧР преимущественно располагается на поверхности клеток ОЩЖ, в которых ингибирует синтез ПТГ, и почек, где регулирует экскрецию кальция с мочой [2][3]. Наличие КЧР также обнаружено в других тканях: в костях, кишечнике, головном мозге, легких и сердце, однако его функция в этих тканях в настоящее время до конца не установлена [4][5][6].
Функционирование КЧР, расположенного в клетках околощитовидных желез, представлено на рисунке 2. Активация КЧР происходит, когда ионы кальция связываются с надмембранным доменом рецептора, что приводит к увеличению активности G-белков, расположенных на внутренней мембране клетки. Передача сигнала, опосредованная G-белками, контролируется при помощи белка RGS5 (регулятор передачи сигналов G-белка 5). Критически важным белком в правильном функционировании КЧР является семейство белков G11/q. Активация данных белков приводит к действию фосфолипазу С, которая катализирует расщепление фосфатидилинозитоладифосфата в диацилглицерол (ДАГ) и инозитолтрифосфат (ИФ3). Главная функция ИФ3 заключается в увеличении концентрации кальция в цитозоле клетки, что реализуется двумя механизмами. Первый механизм реализуется при помощи ИФ3, который связывается со своими рецепторами на поверхности эндоплазматического ритикулома, что способствует выбросу кальция из внутриклеточных депо. Другим механизмом является открытие кальциевых каналов на мембране клетки, что приводит к притоку кальция извне. Все указанные механизмы, опосредованные активацией КЧР, увеличивают внутриклеточную концентрацию кальция. Такое повышение препятствует слиянию секреторных гранул, содержащих ПТГ, с мембраной клетки ОЩЖ. Это приводит к снижению секреции ПТГ, а также к ингибированию реабсорбции кальция почками [7][8][9]. В свою очередь ДАГ совместно с растущей внутриклеточной концентрацией кальция активирует протеинкиназу С, регулятора внутриклеточного сигнального пути МАРК/ERK, который контролирует избыточную пролиферацию клеток ОЩЖ. Другие молекулы — например, фактор роста фибробластов 23 (ФРФ 23) — вместе со своим ко-рецептором Клото также участвуют в работе КЧР, подавляя избыточный синтез ПТГ. Регуляторный путь, опосредованный действием ФРФ 23, в свою очередь, регулируется кальциневрином и его ингибитором RCAN1.
Функционирование КЧР связано с активацией белка-Gq/11, который регулирует дальнейшую работу вторичных посредников, таких как ИФ3 и ДАГ. Действие ИФ3 направлено на увеличение внутриклеточной концентрации кальция, которая подавляет секрецию ПТГ. ДАГ совместно с растущей концентрацией ионов кальция в цитозоле клетки регулирует пролиферацию клеток ОЩЖ через сигнальный путь МАРК/ERK.
Структура КЧР одинакова как в ОЩЖ, так и в почках. В почках КЧР преимущественно располагаются в восходящей толстой части петли Генле (рис. 3а), где увеличивают экспрессию белка плотных контактов — клаудина 14, который ингибирует парацеллюлярную реабсорбцию кальция из мочи [10]. КЧР также встречается в проксимальных канальцах (рис. 3б000), где регулирует экспрессию 1-альфа-гидроксилазы [11] и ингибирует ПТГ-зависимую экскрецию фосфатов с мочой [12]. Все перечисленные механизмы направлены на поддержание необходимой концентрации кальция в крови, что предотвращает избыточную секрецию ПТГ.
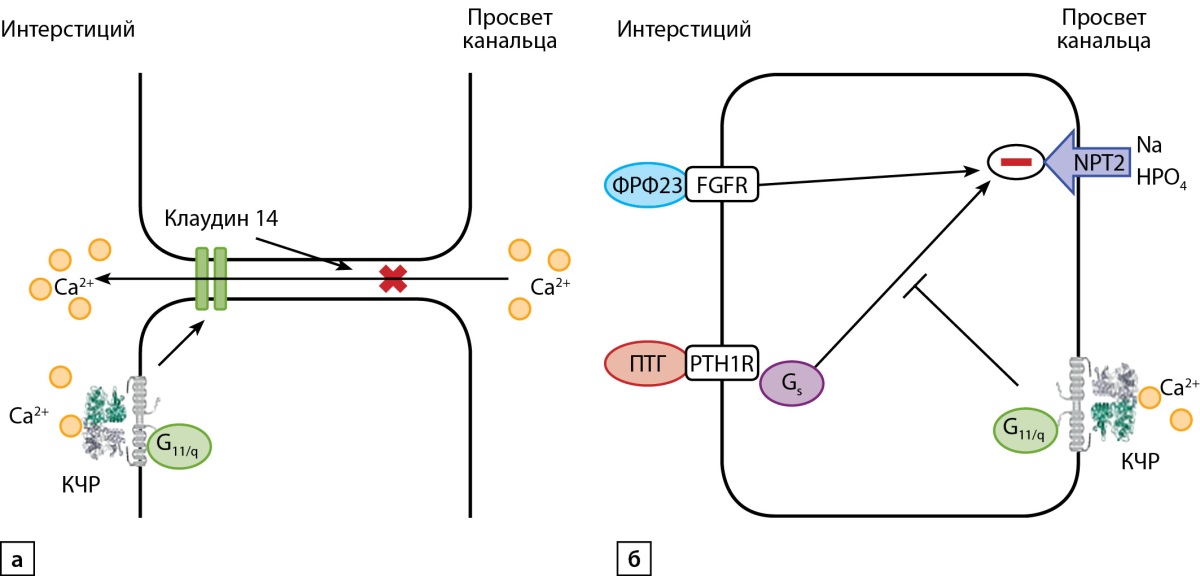
Рисунок 3. Расположение и функционирование
кальций-чувствительного рецептора в
а) восходящей толстой части петли Генле;
б) в проксимальных канальцах почки.
Примечание. КЧР — кальций-чувствительный рецептор;
Ca2+ — ионы кальция; G11/q — представитель семейства G-белков;
ПТГ — паратиреоидный гормон; PTH1R — рецептор к ПТГ 1 типа;
Gs — представитель семейства G-белков;
Na — ионы натрия; HPO4 — фосфаты;
NPT2 — натрий-зависимый фосфатный переносчик 2 типа;
ФРФ 23 — фактор роста фибробластов 23; FGFR — рецептор к ФРФ 23.
а) гиперкальциемия активирует КЧР,
который путем увеличения экспрессии клаудина-14
снижает реабсорбцию кальция в петле Генле;
б) в проксимальных канальцах почки КЧР
расположен на люменальной поверхности клетки.
При повышении концентрации кальция
в просвете канальца происходит активация КЧР,
которая подавляет ингибирующий эффект ПТГ и ФРФ 23
на натрий-зависимый фосфатный переносчик 2 типа (NPT2).
Тем самым возбуждение КЧР увеличивает абсорбцию фосфора из мочи.
Кальций-чувствительный рецептор играет ключевую роль в поддержании кальциевого гомеостаза. Так, у мышей с абляцией гена CaSR развиваются гиперпаратиреоз и выраженная гиперкальциемия [13]. С нарушением экспрессии или функционирования КЧР связан целый ряд заболеваний, обуславливающих неадекватный синтез ПТГ. Так, герминальные мутации, инактивирующие КЧР, приводят к семейной гипокальциурической гиперкальциемии (СГГ) и тяжелому неонатальному гиперпаратиреозу, а мутации, активирующие КЧР, лежат в основе аутосомно-доминантной гипокальциемии (АДГ) [14].
РОЛЬ КЧР В РАЗВИТИИ ПГПТ
Первичный гиперпаратиреоз (ПГПТ) — хроническое заболевание, характеризующееся избыточной и нерегулируемой продукцией паратиреоидного гормона, возникающей вследствие аденомы околощитовидных желез и, как правило, сопровождающееся гиперкальциемией. При этом соматические мутации в гене CaSR крайне редко обнаруживаются при ПГПТ [15][16]. Тогда как однонуклеотидные полиморфизмы в гене CaSR — такие как A986S и R990G — зачастую ассоциированы с более высокими уровнями кальция в крови в общей популяции и с повышенным риском развития ПГПТ [17].
В настоящее время нет полного понимания механизма развития аденом ОЩЖ при ПГПТ. Можно предположить, что снижение экспрессии КЧР в клетках ОЩЖ ведет к нарушению способности паратироцитов реагировать на изменения концентрации кальция в крови, что обуславливает гиперсекрецию ПТГ и усиливает пролиферацию клеток ОЩЖ, приводя к их аденоматозной трансформации [18]. Так, в работе S. Corbetta и соавт. продемонстрировано, что в клетках, полученных из аденом ОЩЖ при ПГПТ, экспрессия КЧР ниже, чем в здоровых клетках ОЩЖ [13]. Обсуждаются и другие механизмы развития аденом ОЩЖ при ПГПТ. Например, авторы [18] при изучении клеток аденом ОЩЖ выявили сниженную экспрессию не только КЧР, но и рецептора витамина D (VDR). Последний сочетался с повышенным уровнем циклина D1, который, в свою очередь, положительно коррелировал с размером аденомы [19]. Это подтверждают и другие исследования: так, в работе Е.А. Ильичевой и соавт. также выявлена сниженная экспрессия КЧР и VDR в клетках аденом ОЩЖ при ПГПТ. При этом сохранение нормальной экспрессии КЧР чаще наблюдалось при множественном поражении ОЩЖ, чем при солидных аденомах ОЩЖ [20].
Вместе с тем в ряде исследований показано отсутствие корреляции между уровнем экспрессии КЧР и степенью подавления ПТГ [8][24]. Учитывая этот факт, можно предположить, что не только экспрессия КЧР играет роль в снижении чувствительности к кальцию клеток ОЩЖ при ПГПТ. У большинства пациентов с ПГПТ функциональная активность КЧР снижена [21]. Потенциальными факторами, которые могут снижать чувствительность КЧР к кальцию, могут являться регулятор передачи сигналов G-белка 5 (RGS5) и регулятор кальциневрина 1 (RCAN1), которые ведут к потере отрицательной обратной связи между уровнями Са в крови и ПТГ [22][23]. Было показано, что мыши с нокаутированным геном RGS5 сохраняли чувствительность к кальцию, и при этом у них наблюдался низкий уровень ПТГ при чрезмерной активации КЧР [22 и 24]. Это подтверждает гипотезу о том, что высокие концентрации RGS5 могут инактивировать КЧР, вызывая избыточную секрецию ПТГ. Экспрессия RGS5 выше у пациентов с ПГПТ, чем у здоровых людей [24]. В клетках аденом ОЩЖ, полученных от пациентов с ПГПТ, высокий уровень RGS5 был ассоциирован со сниженной секрецией ИФ3, т.е. у этих пациентов не наблюдалось внутриклеточного притока кальция, необходимого для КЧР-опосредованного подавления синтеза ПТГ. Для подтверждения негативного влияния повышенной концентрации белка RGS5 на работу КЧР N. Balenga и соавт. изучили эффекты экзогенного RGS5 в культуре клеток ОЩЖ, полученных от здоровых людей. В результате воздействия RGS5 секреция ПТГ клетками ОЩЖ увеличилась [25]. Таким образом, повышенные уровни RGS5, которые характерны для ПГПТ, могут нарушать передачу сигнала через КЧР и, соответственно, снижать его чувствительность к регуляторному действию кальция, что приводит к еще большему синтезу ПТГ.
В тканях, полученных из аденом ОЩЖ, обнаружены высокие уровни белка RCAN1 — эндогенного ингибитора кальциневрина. В норме кальциневрин вместе с фактором роста фибробластов 23 участвует в подавлении секреции ПТГ. Высокая концентрация RCAN1, которая наблюдается в клетках ОЩЖ при ПГПТ, уменьшает активность кальциневрина, тем самым еще больше увеличивая синтез ПТГ [23][25].
РОЛЬ КЧР В РАЗВИТИИ ВГПТ
Вторичный гиперпаратиреоз (ВГПТ) является частым осложнением хронической болезни почек (ХБП). Причинами развития ВГПТ является гиперфосфатемия, нарастающая по мере прогрессирования снижения фильтрационной функции почек, дефицит витамина D и развивающаяся на этом фоне гипокальциемия. ВГПТ характеризуется компенсаторной гиперплазией ОЩЖ, развивающейся вследствие снижения экспрессии КЧР и VDR на паратироцитах, а также вследствие снижения уровня кальцитриола [26]. Гиперплазия ОЩЖ сопровождается хронической избыточной продукцией ПТГ, направленной на коррекцию низких концентраций кальция в крови.
Хроническая гипокальциемия, наблюдающаяся при прогрессии вторичного гиперпаратиреоза, приводит к снижению экспрессии КЧР в клетках ОЩЖ. Из-за этого клетки ОЩЖ у пациентов с ВГПТ приобретают резистентность к изменениям концентрации внеклеточного кальция, поэтому не могут регулировать синтез ПТГ в зависимости от уровня кальция в крови. Это подтверждают результаты работы H. Lee и соавт., в которой изучались клетки ОЩЖ у пациентов с ВГПТ [14]. Показано, что высокие концентрации кальция во внеклеточном пространстве не изменяли концентрацию кальция внутри клеток гиперпализированных ОЩЖ и, соответственно, не подавляли синтез ПТГ.
Активность КЧР также зависит от рН внеклеточной жидкости. Прогрессирующее снижение почечной функции при ХБП зачастую приводит к метаболическому ацидозу. Понижение рН крови вызывает снижение активности КЧР, что приводит к уменьшению внутриклеточной концентрации кальция и, следовательно, еще больше стимулирует синтез ПТГ. Наоборот, смещение рН в щелочную сторону повышает внутриклеточные концентрации кальция, тем самым ингибируя синтез ПТГ [27].
Кальцитриол и VDR принимают непосредственное участие в развитии ВГПТ. Кальцитриол является активной формой витамина D, синтез которой происходит в почках при помощи фермента 1α-гидроксилазы. В норме кальцитриол, воздействуя на VDR, уменьшает синтез ПТГ путем ингибирования экспрессии мРНК ПТГ, а также подавляет гиперплазию клеток ОЩЖ. По мере прогрессирования ХБП снижается объем функционирующей почечной паренхимы, что приводит к уменьшению выработки 1α-гидроксилазы и, следовательно, к снижению выработки кальцитриола. Снижение экспрессии VDR и КЧР в сочетании с дефицитом кальцитриола приводят к уменьшению их регуляторного воздействия на пролиферативную активность паратироцитов, приводя к развитию гиперплазии ОЩЖ. Кальцитриол также может воздействовать на экспрессию гена CaSR, приводя к увеличению количества КЧР на поверхности клеток ОЩЖ, тем самым увеличивая чувствительность паратироцитов к кальцию. Все указанные эффекты активно используются при назначении активных аналогов витамина D для лечения ВГПТ у пациентов со сниженной СКФ [26].
Продолжаются исследования влияния различных молекул, участвующих в фосфорно-кальциевом обмене, на прогрессирование ВГПТ. Фактор роста фибробластов 23 (ФРФ23) — это фосфатурический гормон, играющий ключевую роль в обмене фосфатов. Его обязательным ко-рецептором является трансмембранный белок Клото, который потенцирует биологические эффекты ФРФ 23 [28]. Клото преимущественно располагается на поверхности клеток ОЩЖ и почек, органах, наиболее активно участвующих в регуляции фосфорно-кальциевого обмена. ФРФ 23, образуя комплекс с Клото, активирует сигнальный путь MAPK/ERK, посредством которого уменьшается экспрессия мРНК ПТГ и его синтез в ОЩЖ [29][30]. По мере снижения СКФ снижается экспрессия Клото, что приводит к невозможности подавления избыточной секреции ПТГ, а также к невозможности реализовать фосфатурическое действие ФРФ 23, приводя к стойкой гиперфосфатемии [31]. Высокий уровень фосфора в крови ингибирует КЧР, тем самым увеличивая секрецию ПТГ. Помимо кальций-мобилизирующего эффекта, ПТГ оказывает и фосфатурическое действие, стимулируя почечную экскрецию фосфатов.
При ВГПТ повышение уровня ПТГ направлено не только на коррекцию гипокальциемии, а также на восстановление нормальной концентрации фосфатов в крови, приводя к хронической гиперсекреции ПТГ и прогрессированию ВГПТ [32].
Вызывают интерес взаимоотношения между КЧР и Клото. Оба трансмембранных белка преимущественно расположены на поверхности клеток ОЩЖ и почек и участвуют в подавлении секреции ПТГ, а также регулируют пролиферацию клеток ОЩЖ [33]. Клото может служить дополнительным регулятором синтеза ПТГ, особенно при нарушении функции КЧР. В исследовании Y. Fan и соавт. сравнили мышей с инактивированным геном CaSR и мышей с одновременным отсутствием генов Klotho и CaSR. Во второй группе уровень ПТГ оказался значительно выше, что подтверждает предположение о самостоятельной роли Клото в подавлении секреции ПТГ, особенно в отсутствие КЧР [34]. Таким образом, КЧР и Клото совместно предотвращают развитие гиперплазии ОЩЖ и избыточную секрецию ПТГ.
РОЛЬ КЧР В РАЗВИТИИ НАСЛЕДСТВЕННЫХ ЗАБОЛЕВАНИЙ, АССОЦИИРОВАННЫХ С НАРУШЕНИЕМ ФОСФОРНО-КАЛЬЦИЕВОГО ОБМЕНА
Семейная гипокальциурическая гиперкальциемия (СГГ) — это группа аутосомно-доминантных заболеваний, преимущественно обусловленных мутациями в гене CaSR. Указанные мутации приводят к снижению чувствительности рецептора к кальцию. В результате для подавления избыточной продукции ПТГ требуются более высокие, чем обычно, концентрации кальция в крови. В почках данный дефект приводит к увеличению канальцевой реабсорбции кальция. Лабораторными проявлениями СГГ обычно являются умеренная гиперкальциемия, гипокальциурия (низкое отношение почечного клиренса кальция к клиренсу креатинина (<0,01)), уровень ПТГ чаще всего находится в пределах референсного диапазона либо незначительно его превышает. Заболевание преимущественно протекает бессимптомно и является случайной находкой. Похожие лабораторные изменения могут наблюдаться при ПГПТ, что требует тщательной дифференциальной диагностики между данными заболеваниями, так как прогноз и тактика лечения значительно различаются. Прогноз при СГГ благоприятный, а паратиреоидэктомия не приводит к нормализации уровней кальция в крови [35].
Еще одним заболеванием, возникающим вследствие инактивирующей мутации CaSR, является тяжелый неонатальный гиперпаратиреоз. Сниженная чувствительность КЧР к кальцию приводит к неспособности подавить избыточный синтез ПТГ, что обуславливает развитие выраженной гиперкальциемии. У таких пациентов с рождения наблюдается высокий уровень кальция в крови (>3,5 ммоль/л), повышение ПТГ и иногда гипокальциурия, развивающаяся из-за повышения реабсорбции кальция в почках. Указанные нарушения кальциевого гомеостаза обуславливают дефекты минерализации костной ткани, и в дальнейшем могут приводить к развитию переломов, а также к респираторному дистресс-синдрому вследствие деформации грудной клетки. Выраженность данных проявлений определяет продолжительность жизни таких пациентов [36]. Ранее единственным видом лечения неонатального гиперпаратиреоза была тотальная паратиреоидэктомия, однако в настоящее время применение лекарственных препаратов, таких как бисфосфонаты и кальцимиметики, показывает не меньшую эффективность [37].
Семейный изолированный гиперпаратиреоз (FIHP) является редкой наследственной формой ПГПТ с аутосомно-доминантным типом наследования. Его развитие может быть обусловлено инактивирующими мутациями в различных генах: MEN1, CDC73 или CаSR. FIHP является диагнозом исключения, так как мутации в генах MEN1 и CDC73 могут приводить к развитию других наследственных заболеваний, где ПГПТ является только одним из их компонентов. Для постановки диагноза FIHP должен выполняться ряд критериев: 1) наличие ПГПТ как у пациента, так и как минимум у одного родственника первой линии родства; 2) наличие хотя бы одной аденомы ОЩЖ, подтвержденной гистологически; 3) отсутствие других опухолей эндокринных и неэндокринных органов. FIHP чаще всего диагностируется в молодом возрасте и проявляется классическими клиническими и лабораторными признаками ПГПТ. Паратиреоидэктомия является обязательным этапом лечения, объем оперативного вмешательства определяется в зависимости от генетического варианта заболевания [38][39].
Аутосомно доминантная гипокальциемия (АДГ) возникает вследствие активирующей мутации в гене CaSR, увеличивающей чувствительность к внеклеточным концентрациям ионизированного кальция. В результате этого нарушения синтез и секреция ПТГ подавлены, несмотря на нормальные уровни кальция в крови. Лабораторные показатели при АДГ характеризуются низкой концентрацией кальция в крови в сочетании с нормальным или низким уровнем ПТГ в крови, а также неадекватно повышенной экскрецией кальция с мочой (обусловленной низкими циркулирующими уровнями ПТГ из-за чрезмерной активации КЧР). Примерно у половины пациентов с АДГ проявляются симптомы гипокальциемии, для купирования которых используют активные метаболиты витамина D и препараты кальция [40]. В некоторых случаях АДГ ассоциирована с синдромом Барттера V типа. Повышенная активность КЧР ингибирует работу Na-K-Cl-котранспортера, это ведет к потере ионов натрия, калия, хлора и водорода с мочой, что проявляется гипокалиемией, метаболическим алкалозом, гиперренинемией и гиперальдостеронизмом без гипертензии [14][41].
Идиопатическая гиперкальциурия — это метаболическое нарушение, характеризующееся повышенной экскрецией кальция с мочой (более 6,3 ммоль/сутки для женщин и более 7,5 ммоль/сутки для мужчин) при нормокальциемии и нормальном или незначительно повышенном уровне ПТГ, приводящее к нефролитиазу. Данные изменения при лабораторном исследовании также могут встречаться при нормокальциемическом варианте ПГПТ, что требует проведения дифференциальной диагностики указанных состояний [42]. Идиопатическая гиперкальциурия является причиной нефролитиаза у 60% пациентов с мочекаменной болезнью [43]. Причины возникновения идиопатической гиперкальциурии до конца не установлены, в качестве потенциальных рассматривают снижение реабсорбции кальция в проксимальных почечных канальцах и восходящей части петли Генле, а также повышенную реабсорбцию кальция в кишечнике и усиление резорбции костной ткани. Нарушения метаболизма витамина D, а также снижение чувствительности КЧР и рецептора витамина D могут приводить к данным нарушениям [44][45]. У лиц с идиопатической гиперкальциурией прослеживается наследственная предрасположенность к нефролитиазу, хотя герминальные мутации гена КЧР не были обнаружены при этом заболевании. Однако полиморфизмы гена CaSR способны привести к гиперкальциурии в сочетании с нефролитиазом. Так, полиморфизм Arg990Gly (замена глицина в позиции 990 на аргинин), а также полиморфизмы rs1042636 (АА), rs1801725 (GG) и rs6776158 (AG) встречаются у пациентов с мочекаменной болезнью [46–49].
ЗАКЛЮЧЕНИЕ
КЧР преимущественно располагается на поверхности клеток околощитовидных желез и реагирует на изменения концентрации кальция в крови, регулируя синтез ПТГ. Низкие концентрации кальция стимулируют синтез ПТГ, который, в свою очередь, способствует резорбции костной ткани, реабсорбции кальция в почках и синтезу активной формы витамина D. В ситуации, когда концентрация ионизированного кальция в крови повышается, происходит активация КЧР, результатом которой является ингибирование синтеза ПТГ и пролиферации клеток ОЩЖ. Нарушения в функционировании КЧР лежат в основе развития таких заболеваний, как первичный и вторичный гиперпаратиреоз, семейная гипокальциурическая гиперкальциемия, аутосомно доминантная гипокальциемия и ряд других. Степень снижения чувствительности КЧР к кальцию может обуславливать различную выраженность клинических проявлений данных заболеваний. Изучение внутриклеточных процессов, опосредованных активацией КЧР, а также молекул, способных оказывать влияние на изменение чувствительности КЧР, поможет выработать новые подходы к лечению заболеваний, ассоциированных с развитием гиперпаратиреоза.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Мармалюк Д.А. — разработка концепции и идеи статьи, анализ и интерпретация данных, написание статьи; Рунова Г.Е. — концепция и идея статьи, внесение правки с целью повышения научной ценности статьи; Фадеев В.В. — разработка концепции, редактирование и окончательное утверждение рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Sundararaman SS, van der Vorst EPC. Calcium-Sensing Receptor (CaSR), Its Impact on Inflammation and the Consequences on Cardiovascular Health. Int J Mol Sci. 2021;22(5):2478. doi: https://doi.org/10.3390/ijms22052478
2. Brown EM, MacLeod RJ. Extracellular calcium sensing and extracellular calcium signaling. Physiol Rev. 2001;81(1):239-297. doi: https://doi.org/10.1152/physrev.2001.81.1.239
3. Мирная С.С., Пигарова Е.А., Беляева А.В. и др. Роль кальцийчувствительного рецептора в поддержании системы кальциевого гомеостаза // Остеопороз и остеопатии. — 2010. — Т. 13. — №3. — С. 32-36. doi: https://doi.org/10.14341/osteo2010332-36
4. Barahona MJ, Maina RM, Lysyy T, et al. Activation of the Calcium Sensing Receptor Decreases Secretagogue-Induced Fluid Secretion in the Rat Small Intestine. Front Physiol. 2019;10:439. doi: https://doi.org/10.3389/fphys.2019.00439
5. Ruat M, Traiffort E. Roles of the calcium sensing receptor in the central nervous system. Best Pract Res Clin Endocrinol Metab. 2013;27(3):429-442. doi: https://doi.org/10.1016/j.beem.2013.03.001
6. Schepelmann M, Yarova PL, Lopez-Fernandez I, et al. The vascular Ca2+-sensing receptor regulates blood vessel tone and blood pressure. Am J Physiol Cell Physiol. 2016;310(3):C193-C204. doi: https://doi.org/10.1152/ajpcell.00248.2015
7. Minisola S, Arnold A, Belaya Z, et al. Epidemiology, Pathophysiology, and Genetics of Primary Hyperparathyroidism. J Bone Miner Res. 2022;37(11):2315-2329. doi: https://doi.org/10.1002/jbmr.4665
8. Conigrave AD, Ward DT. Calcium-sensing receptor (CaSR): pharmacological properties and signaling pathways. Best Pract Res Clin Endocrinol Metab. 2013;27(3):315-331. doi: https://doi.org/10.1016/j.beem.2013.05.010
9. Hofer AM, Brown EM. Extracellular calcium sensing and signalling. Nat Rev Mol Cell Biol. 2003;4(7):530-538. doi: https://doi.org/10.1038/nrm1154
10. Sato T, Courbebaisse M, Ide N, et al. Parathyroid hormone controls paracellular Ca2+ transport in the thick ascending limb by regulating the tight-junction protein Claudin14. Proc Natl Acad Sci USA. 2017;114(16):E3344-E3353. doi: https://doi.org/10.1073/pnas.1616733114
11. Toka HR, Al-Romaih K, Koshy JM, et al. Deficiency of the calcium-sensing receptor in the kidney causes parathyroid hormone-independent hypocalciuria. J Am Soc Nephrol. 2012;23(11):1879-1890. doi: https://doi.org/10.1681/ASN.2012030323
12. Ba J, Brown D, Friedman PA. Calcium-sensing receptor regulation of PTH-inhibitable proximal tubule phosphate transport. Am J Physiol Renal Physiol. 2003;285(6):F1233-F1243. doi: https://doi.org/10.1152/ajprenal.00249.2003
13. Chang W, Tu C, Chen TH, et al. The extracellular calcium-sensing receptor (CaSR) is a critical modulator of skeletal development. Sci Signal. 2008;1(35). doi: https://doi.org/10.1126/scisignal.1159945
14. Hannan FM, Kallay E, Chang W, et al. The calcium-sensing receptor in physiology and in calcitropic and noncalcitropic diseases. Nat Rev Endocrinol. 2018;15(1):33-51. doi: https://doi.org/10.1038/s41574-018-0115-0
15. Pearce SH, Brown EM. Calcium-sensing receptor mutations: insights into a structurally and functionally novel receptor. J Clin Endocrinol Metab. 1996;81(4):1309-1311. doi: https://doi.org/10.1210/jcem.81.4.8636322
16. Singh P, Bhadada SK, Dahiya D, et al. Reduced Calcium Sensing Receptor (CaSR) Expression Is Epigenetically Deregulated in Parathyroid Adenomas. J Clin Endocrinol Metab. 2020;105(9):3015-3024. doi: https://doi.org/10.1210/clinem/dgaa419
17. Wang XM, Wu YW, Li ZJ, et al. Polymorphisms of CASR gene increase the risk of primary hyperparathyroidism. J Endocrinol Invest. 2016;39(6):617-625. doi: https://doi.org/10.1007/s40618-015-0405-5
18. Brown AJ, Zhong M, Finch J, et al. Rat calcium-sensing receptor is regulated by vitamin D but not by calcium. Am J Physiol. 1996;270(3 Pt 2):F454-F460. doi: https://doi.org/10.1152/ajprenal.1996.270.3.F454
19. Varshney S, Bhadada SK, Saikia UN, et al. Simultaneous expression analysis of vitamin D receptor, calcium-sensing receptor, cyclin D1, and PTH in symptomatic primary hyperparathyroidism in Asian Indians. Eur J Endocrinol. 2013;169(1):109-116. doi: https://doi.org/10.1530/EJE-13-0085
20. Ильичева Е.А., Шурыгина И.А., Дремина Н.Н. и др. Роль кальцийчувствительного и витамин D рецепторов в патогенезе множественного поражения околощитовидных желез при спорадическом первичном гиперпаратиреозе // Проблемы Эндокринологии. — Т. 2023-Т. 69. — №3. — С. 24-34 doi: https://doi.org/10.14341/probl13207
21. Koh J, Zhang R, Roman S, et al. Ex Vivo Intact Tissue Analysis Reveals Alternative Calcium-sensing Behaviors in Parathyroid Adenomas. J Clin Endocrinol Metab. 2021;106(11):3168-3183. doi: https://doi.org/10.1210/clinem/dgab524
22. Koh J, Dar M, Untch BR, et al. Regulator of G protein signaling 5 is highly expressed in parathyroid tumors and inhibits signaling by the calcium-sensing receptor. Mol Endocrinol. 2011;25(5):867-876. doi: https://doi.org/10.1210/me.2010-0277
23. Balenga N, Koh J, Azimzadeh P, et al. Parathyroid-Targeted Overexpression of Regulator of G-Protein Signaling 5 (RGS5) Causes Hyperparathyroidism in Transgenic Mice. J Bone Miner Res. 2019;34(5):955-963. doi: https://doi.org/10.1002/jbmr.3674
24. Balenga N, Azimzadeh P, Hogue JA, et al. Orphan adhesion GPCR GPR64/ADGRG2 is overexpressed in parathyroid tumors and attenuates calcium-sensing receptor-mediated signaling. J Bone Miner Res. 2017;32(3):654-666. doi: https://doi.org/10.1002/jbmr.3023
25. Olauson H, Lindberg K, Amin R, et al. Parathyroidspecific deletion of Klotho unravels a novel calcineurin-dependent FGF23 signaling pathway that regulates PTH secretion. PLoS Genet. 2013;9(12):e1003975. doi: https://doi.org/10.1371/journal.pgen.1003975
26. Xiang Z, Wang M, Miao C, Jin D, Wang H. Mechanism of calcitriol regulating parathyroid cells in secondary hyperparathyroidism. Front Pharmacol. 2022;13:1020858. doi: https://doi.org/10.3389/fphar.2022.1020858
27. Campion KL, McCormick WD, Warwicker J, et al. Pathophysiologic changes in extracellular pH modulate parathyroid calcium-sensing receptor activity and scretion via a histidine-independent mechanism. J Am Soc Nephrol. 2015;26(9):2163-2171. doi: https://doi.org/10.1681/ASN.2014070653
28. Urakawa I, Yamazaki Y, Shimada T, et al. Klotho converts canonical FGF receptor into a specific receptor for FGF23. Nature. 2006;444(7120):770-774. doi: https://doi.org/10.1038/nature05315
29. Krajisnik T, Bjorklund P, Marsell R, et al. Fibroblast growth factor-23 regulates parathyroid hormone and 1alpha-hydroxylase expression in cultured bovine parathyroid cells. J Endocrinol. 2007;195(1):125-131. doi: https://doi.org/10.1677/JOE-07-0267
30. Ильин А.В., Арбузова М.И. Фактор роста фибробластов 23 и белок Klotho в патогенезе вторичного гиперпаратиреоза // Остеопороз и остеопатии. — 2013. — Т. 16. — №3. — С. 20-27. doi: https://doi.org/10.14341/osteo2013320-27
31. Arnold A, Brown MF, Urena P, et al. Monoclonality of parathyroid tumors in chronic renal failure and in primary parathyroid hyperplasia. J Clin Invest. 1995;95(5):2047-2053. doi: https://doi.org/10.1172/JCI117890
32. Centeno PP, Herberger A, Mun HC, et al. Phosphate acts directly on the calcium-sensing receptor to stimulate parathyroid hormone secretion. Nat Commun. 2019;10(1):4693. doi:10.1038/s41467-019-12399-9
33. Baradaran A. Relationship between Klotho and parathormone. J Parathyr Dis. 2023;11:e11230. doi: https://doi.org/10.34172/jpd.2023.11230
34. Fan Y, Liu W, Bi R, et al. Interrelated role of Klotho and calcium-sensing receptor in parathyroid hormone synthesis and parathyroid hyperplasia. Proc Natl Acad Sci USA. 2018;115(16):E3749-E3758. doi: https://doi.org/10.1073/pnas.1717754115
35. Lee JY, Shoback DM. Familial hypocalciuric hypercalcemia and related disorders. Best Pract Res Clin Endocrinol Metab. 2018;32(5):609-619. doi: https://doi.org/10.1016/j.beem.2018.05.004
36. Sadacharan D, Mahadevan S, Rao SS, et al. Neonatal Severe Primary Hyperparathyroidism: A Series of Four Cases and their Long-term Management in India. Indian J Endocrinol Metab. 2020;24(2):196-201. doi: https://doi.org/10.4103/ijem.IJEM_53_20
37. Fisher MM, Cabrera SM, Imel EA. Successful treatment of neonatal severe hyperparathyroidism with cinacalcet in two patients. Endocrinol Diabetes Metab Case Rep. 2015;2015:150040. doi: https://doi.org/10.1530/EDM-15-0040
38. Cristina EV, Alberto F. Management of familial hyperparathyroidism syndromes: MEN1, MEN2, MEN4, HPT-Jaw tumour, Familial isolated hyperparathyroidism, FHH, and neonatal severe hyperparathyroidism. Best Pract Res Clin Endocrinol Metab. 2018;32(6):861-875. doi: https://doi.org/10.1016/j.beem.2018.09.010
39. Горбачева А.М., Еремкина А.К., Мокрышева Н.Г. Наследственные «ндромальные и несиндромальные формы первичного гиперпаратиреоза // Проблемы Эндокринологии. — 2020. — Т. 66. — №1. — С. 23-34. 2020;66(1):23-34. doi: https://doi.org/10.14341/probl10357
40. Roszko KL, Bi RD, Mannstadt M. Autosomal Dominant Hypocalcemia (Hypoparathyroidism) Types 1 and 2. Front Physiol. 2016;7:458. doi: https://doi.org/10.3389/fphys.2016.00458
41. Mrad FCC, Soares SBM, de Menezes Silva LAW, et al. Bartter's syndrome: clinical findings, genetic causes and therapeutic approach. World J Pediatr. 2021;17(1):31-39. doi: https://doi.org/10.1007/s12519-020-00370-4
42. Рунова Г.Е., Голоунина О.О., Глинкина И.В. и др. Дифференциальная диагностика нормокальциемического варианта первичного гиперпаратиреоза и идиопатической гиперкальциурии на примере клинического случая // Проблемы Эндокринологии. — 2020. — Т. 66. — №6. — С. 13-17. doi: https://doi.org/10.14341/probl12677
43. Worcester EM, Coe FL. New insights into the pathogenesis of idiopathic hypercalciuria. Semin Nephrol. 2008;28(2):120-132. doi: https://doi.org/10.1016/j.semnephrol.2008.01.005
44. Garda Nieto VM, Luis Yanes MI, Tejera Carreno P, et al. The idiopathic hypercalciuria reviewed. Metabolic abnormality or disease? Nefrologia (Engl Ed). 2019;39(6):592-602. doi: https://doi.org/10.1016/j.nefro.2019.02.011
45. Голодников И.И., Павлова З.Ш., Камалов А.А., Савилов А.В. Кальций-чувствительный рецептор, а-клото и FGF21 в развитии нефролитиаза. Технологии живых систем. — 2021. — Т. 18. — №1. — С. 32-40. doi: https://doi.org/10.18127/j20700997-202101-03
46. Vezzoli G, Tanini A, Ferrucci L, et al. Influence of calcium-sensing receptor gene on urinary calcium excretion in stoneforming patients. J Am Soc Nephrol. 2002;13(10):2517-2523. doi: https://doi.org/10.1097/01.asn.0000030077.72157.d2
47. Litvinova MM, Khafizov K, Korchagin VI, et al. Association of CASR, CALCR, and ORAI1 Genes Polymorphisms With the Calcium Urolithiasis Development in Russian Population. Front Genet. 2021;12:621049. doi: https://doi.org/10.3389/fgene.2021.621049
48. Patel YP, Pandey SN, Patel SB, et al. Haplotype of CaSR gene is associated with risk of renal stone disease in West Indian population. Urolithiasis. 2022;51(1):25. doi: https://doi.org/10.1007/s00240-022-01394-3
49. Vezzoli G, Terranegra A, Aloia A, et al. Decreased transcriptional activity of calcium-sensing receptor gene promoter 1 is associated with calcium nephrolithiasis. J Clin Endocrinol Metab. 2013;98(9):3839-3847. doi: https://doi.org/10.1210/jc.2013-1834
Об авторах
Д. А. МармалюкРоссия
Мармалюк Дарья Александровна - врач-ординатор, кафедра эндокринологии №1, ИКМ.
119991, Москва, ул. Трубецкая, д. 8, стр. 2
Конфликт интересов:
Нет
Г. Е. Рунова
Россия
Рунова Гюзель Евгеньевна - к.м.н., доцент кафедры эндокринологии №1, ИКМ.
Москва
Конфликт интересов:
Нет
В. В. Фадеев
Россия
Фадеев Валентин Викторович - д.м.н., профессор, член-корр. РАН, заведующий кафедрой эндокринологии №1, ИКМ.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Схематическое строение кальций-чувствительного рецептора. | |
| Тема | ||
| Тип | Материалы исследования | |
Посмотреть
(232KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Сигнальные пути, опосредованные активацией кальций-чувствительного рецептора, в клетках околощитовидных желез. | |
| Тема | ||
| Тип | Материалы исследования | |
Посмотреть
(174KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Расположение и функционирование кальций-чувствительного рецептора в а) восходящей толстой части петли Генле; б) в проксимальных канальцах почки. | |
| Тема | ||
| Тип | Материалы исследования | |
Посмотреть
(196KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Мармалюк Д.А., Рунова Г.Е., Фадеев В.В. Роль кальций-чувствительного рецептора в регуляции синтеза паратиреоидного гормона в норме и при патологии. Остеопороз и остеопатии. 2023;26(3):25-32. https://doi.org/10.14341/osteo13142
For citation:
Marmalyuk D.A., Runova G.E., Fadeyev V.V. The role of the calcium-sensing receptor in the regulation of parathyroid hormone secretion in physiology and in calcitropic diseases. Osteoporosis and Bone Diseases. 2023;26(3):25-32. (In Russ.) https://doi.org/10.14341/osteo13142

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































