Перейти к:
Диагностика гипофосфатазии во взрослом возрасте: клинические случаи и обзор литературы
https://doi.org/10.14341/osteo13180
Аннотация
Гипофосфатазия (HPP) — наследственное метаболическое заболевание, характеризующееся низкой активностью ткань-неспецифической щелочной фосфатазы (TNAP) вследствие мутаций в гене ALPL [1]. Низкая активность TNAP приводит к системному накоплению его субстратов, а именно неорганического пирофосфата (PPi), сильного ингибитора минерализации, и пиридоксаль-5’-фосфата (PLP), кофактора нескольких ферментов, которые в значительной степени объясняют скелетно-мышечные и системные особенности заболевания. Гипофосфатазия характеризуется широким спектром проявлений и различной степенью тяжести: от бессимптомного течения у носителей мутации ALPL до внутриутробной смерти при перинатальной форме. В данной статье будет рассмотрена манифестация заболевания во взрослом возрасте, которая требует дифференциальной диагностики с постменопаузальным остеопорозом.
Для цитирования:
Магеррамова С.Т., Тютюгина Ю.В., Белая Ж.Е. Диагностика гипофосфатазии во взрослом возрасте: клинические случаи и обзор литературы. Остеопороз и остеопатии. 2024;27(4):11-16. https://doi.org/10.14341/osteo13180
For citation:
Magerramova S.T., Tyutyugina Yu.V., Belaya Zh.E. Hypophosphatasia diagnosis in adults: clinical case and literature review. Osteoporosis and Bone Diseases. 2024;27(4):11-16. (In Russ.) https://doi.org/10.14341/osteo13180
АКТУАЛЬНОСТЬ
К настоящему времени зарегистрировано более 400 мутаций гена ALPL (в основном миссенс) https://alplmutationdatabase.jku.at/portal/, наследуемых либо аутосомно-доминантным, либо рецессивным способом. Тяжелое течение гипофосфатазии встречается редко, его частота составляет от 1:100 000 живорождений в Канаде [2] до 1:300 000 в Европе [3], в то время как предполагаемая распространенность сравнительно более легкой взрослой формы составляет от 1:3100 до 1:508 у европейцев [4][5][6].
С момента первого описания заболевания Дж. К. Ратбуном в 1948 г. [7] достигнут значительный прогресс в изучении патофизиологии, а также в диагностике и лечении гипофосфатазии [8][9][10][11].
Из-за редкой встречаемости заболевания, недостаточной осведомленности практикующих врачей о данной патологии и отсутствия патогномоничных симптомов, особенно при легкой форме у взрослых, все еще существуют значительные трудности в его своевременной диагностике и, соответственно, лечении [12].
Классификация гипофосфатазии основана на возрасте пациента на момент появления первых признаков или симптомов заболевания. Таким образом выделяют перинатальную, инфантильную, детскую, взрослую формы заболевания и одонтогипофосфатазию [13]. Большинству клинических форм заболевания присущи одни и те же признаки и симптомы с перекрывающимися клиническими проявлениями, которые различаются по интенсивности. Хотя серьезные осложнения возникают преимущественно в детском возрасте, они могут развиться в любом возрасте [14].
При перинатальной форме гипофосфатазии, наиболее тяжелой форме заболевания, признаки заболевания могут присутствовать при УЗИ-скрининге. Так могут выявляться признаки укорочения трубчатых костей, их деминирализации. Эта форма заболевания проявляется диффузной деминерализацией костей, гипоплазией легких, дыхательной недостаточностью, требующей искусственной вентиляции легких, гипотонией и судорогами, обусловленными дефицитом витамина В6 в центральной нервной системе, отсутствием нормального набора веса. Перинатальная форма гипофосфатазии имеет неблагоприятный прогноз и при отсутствии лечения приводит к летальному исходу [15][16][17].
Инфантильная форма гипофосфатазии проявляется в первые 6 месяцев жизни и может варьироваться от легкой степени до тяжелой [13]. У пациентов с инфантильной формой гипофосфатазии наблюдаются изменения костей, типичные для рахита, такие как утолщение реберно-хрящевых сочленений, расширение суставных щелей, неоднородная структура метафиза и деформации конечностей. Низкий рост и мышечная слабость способствуют задержке моторного развития [13][18].
Одонтогипофосфатазия, наиболее распространенная форма заболевания, проявляется ранней потерей молочных зубов в детстве или ранней потерей коренных зубов во взрослом возрасте при отсутсвии костных аномалий. Потеря зуба происходит при неповрежденном корне и вызвана аномалиями цемента, что приводит к ослаблению прикрепления зуба в альвеоле [20].
Ранняя потеря зубов может наблюдаться при всех формах гипофосфатазии и является важным признаком заболевания в детском возрасте [21].
Взрослая форма гипофосфатазии характеризуется повышенным риском переломов, особенно характерны переломы плюсневых костей и переломы бедра, которые можно классифицировать как атипичные переломы, мышечной слабостью и хронической мышечно-скелетной болью [19]. Кроме того, избыток неразрушенного пирофосфата откладывается в суставах и хрящах в виде пирофосфата кальция, что приводит к хондрокальцинозу, болевому синдрому и клинически проявляется более быстрым прогрессированием остеоартрита и в ряде случаев — ранними заменами суставов [22]. Эктопическая кальцификация различной степени тяжести является частым проявлением взрослой формы гипофосфатазии [23]. Ввиду неспецифичности симптомов пациент с гипофосфатазией может получать лечение остеоартроза и остеопороза, оставаясь недиагностированным, при этом наиболее часто применяемые препараты для лечения остеопороза — бисфосфонаты (БФ) [24][25] — являются аналогами пирофосфата и противопоказаны при гипофосфатазии. Таким образом, важно, чтобы у врачей, которые занимаются проблемой остеопороза, сохранялась настороженность в отношении этого редкого заболевания, которое может быть впервые диагностировано среди старшей возрастной группы. Мы представляем клинический случай пациентки с манифестацией гипофосфатазии во взрослом возрасте.
ОПИСАНИЕ СЛУЧАЯ
Пациентка А. 55 лет обратилась с жалобами на мышечные боли во всем теле, усиливающиеся утром, скованность по утрам, мышечные спазмы, судороги жевательных, шейных, икроножных мышц преимущественно вечером, головные боли, боли в пояснице тянущего характера. При осмотре: телосложение правильное, нормостеническое (ИМТ — 24,1 кг/м²). Из анамнеза известно, что у пациентки уже были переломы плюсневой кости и перелом бедра, возникшие при минимальной травме, а также другие переломы (табл. 1). Пациентка наблюдается у невролога с диагнозом: хроническая, ежедневная головная боль, обусловленная дисфункцией перикраниальных и жевательных мышц; торсионная дистония, краниальная дистония в виде дистонического тризма, дистонический тремор головы. Длительное время получает лечение: клоназепам по 1/4 таблетки на ночь (прием нерегулярный), баклофен (миорелаксант центрального действия) 10 мг по 1 таблетке на ночь.
Таблица 1. Переломы в анамненезе пациентки
|
Возраст |
Локализация перелома |
|
17 лет |
Перелом костей в области левого голеностопного сустава |
|
45 лет |
Перелом мизинца левой стопы (ударилась об дверной косяк) |
|
49 лет |
Перелом шейки левой бедренной кости (при падении с высоты собственного роста) |
|
52 года |
Перелом основания V плюсневой кости левой стопы (подвернула ногу) |
|
54 года |
Перелом основной фаланги второго пальца левой стопы без смещения (ударилась о камень во время плавания) |
|
54 года |
Перелом основания V плюсневой кости правой стопы |
|
55 лет |
Закрытый краевой перелом надколенника без смещения, дегенеративное повреждение наружного мениска (упала на колени) |
При многократных исследованиях щелочная фосфатаза находилась ниже референсного интервала: впервые в возрасте 51 года — 23 Ед/л (40—120), в этом же возрасте у пациентки наступила менопауза. В возрасте 50 лет у пациентки произошел перелом шейки левой бедренной кости при падении с высоты собственного роста, который плохо заживал несмотря на проведенное хирургическое лечение. На тот момент, при денситометрии, минеральная плотность костной ткани (МПКТ) в L1–L4 — -1,4SD, в шейке бедра — -0,1SD, total — -1,6SD по Z-критерию. Пациентка нерегулярно принимала альфакальцидол 0,25 мкг/сут, от предложенной инфузии золедроновой кислоты 5 мг воздержалась. При контрольной денситометрии в возрасте 55 лет отмечалась отрицательная динамика: МПК в L1–L4 — -2,2SD, в шейке бедра — -2,4SD, все бедро — -1,5SD по Т-критерию, по всей видимости, обусловленная менопаузой. В возрасте 54 лет в связи с многократно подтвержденным низким уровнем щелочной фосфатазы у пациентки была заподозрена гипофосфатазия, и проведено секвенирование по Сенгеру, выявлен описанный ранее как патогенный вариант нуклеотидной последовательности в экзоне 4 гена ALPL с.211С>Т, в гетерозиготном состоянии приводящий к миссенс-замене.
Пациентке было проведено обследование для оценки состояния фосфорно-кальциевого обмена, все показатели были в пределах референсных значений, за исключением щелочной фосфатазы, которая при двукратном определении была снижена до 29 Ед/л (40–150) (табл. 2).
Таблица 2. Данные лабораторного обследования пациентки
|
Показатель |
Результат |
Референсные интервалы |
|
Кальций скорректированный на альбумин, ммоль/л |
2,27 |
2,15–2,6 |
|
Фосфор, ммоль/л |
1,33 |
0,74–1,52 |
|
Магний, ммоль/л |
0,94 |
0,7–1,05 |
|
Щелочная фосфотаза, ед/л |
29 (двумя днями позже 29) |
40–150 |
|
Глюкоза, ммоль/л |
5,08 |
3,1–6,1 |
|
Креатинин, мкмоль/л (рСКФ) |
69,6 (85 мл/мин/1,73 м²) |
50–98 |
|
Железо, мкмоль/л |
18,1 |
9–30,4 |
|
ТТГ, мМЕ/л |
1,22 |
0,25–3,5 |
|
Паратгормон, пг/мл |
25,08 |
15–65 |
|
С-концевой телопептид, нг/мл |
0,65 |
0,3–1,1 |
|
Остеокальцин, нг/мл |
25,31 |
15–65 |
|
Витамин D, нг/мл |
32 |
>30 |
Проведена постуральная рентгенограмма нижних конечностей (рис. 1), выявлено укорочение шейки левой бедренной кости на фоне консолидированного перелома слева с деформацией субкапитальной зоны, консолидированный перелом основания тела левой седалищной кости с деформацией подвздошно-седалищной борозды, асимметрия лобкового симфиза с опущением и смещением кзади левой половины до 0,6 мм, ротационные подвывихи головок бедренных костей, больше слева, видимое сужение левого запирательного отверстия на фоне опорной перенагрузки с наружного ребра правой стопы на зону левой пятки.
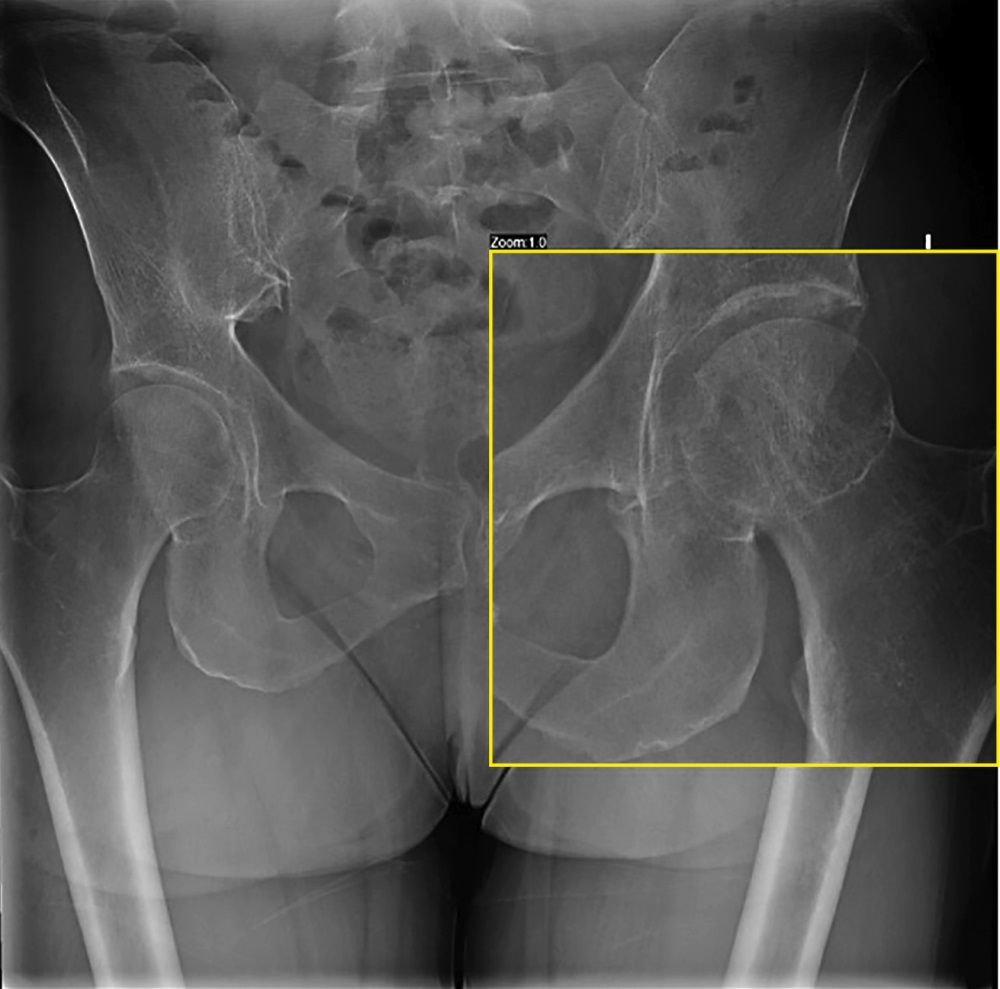
Рисунок 1. Консолидированный перелом основания тела левой седалищной кости с деформацией подвздошно-седалищной борозды.
При исследовании состояния костной ткани маркеры костного обмена — в пределах референсных значений: остеокальцин — 25,31 нг/мл (24,0–70,0), С-концевой телопептид коллагена 1 типа — 0,65 нг/мл (0,10–0,85). По данным МРТ грудного и поясничного отделов позвоночника (рис. 2, 3) — картина дегенеративно-дистрофических изменений (остеохондроз, спондилоартроз), грыжа межпозвонкового диска на уровне Th5-6 и Th8-9, выстояние межпозвонкового диска на уровне Th7-8, Th11-12, Th12/L1 и L4/L5, гемангиома в теле Th8 позвонка, протрузия межпозвонкового диска на уровне L4/L5. Данных за наличие компрессионных переломов позвонков не выявлено. По данным рентген-денситометрии выявлено снижение МПКТ в L1–L4 до -2.5 SD по Т-критерию — соответствует остеопорозу, в шейке левой бедренной кости — до -2.2 SD, в бедре в целом — до -1.9 SD, в лучевой кости — 1/3 до -2.0 SD по Т-критерию.
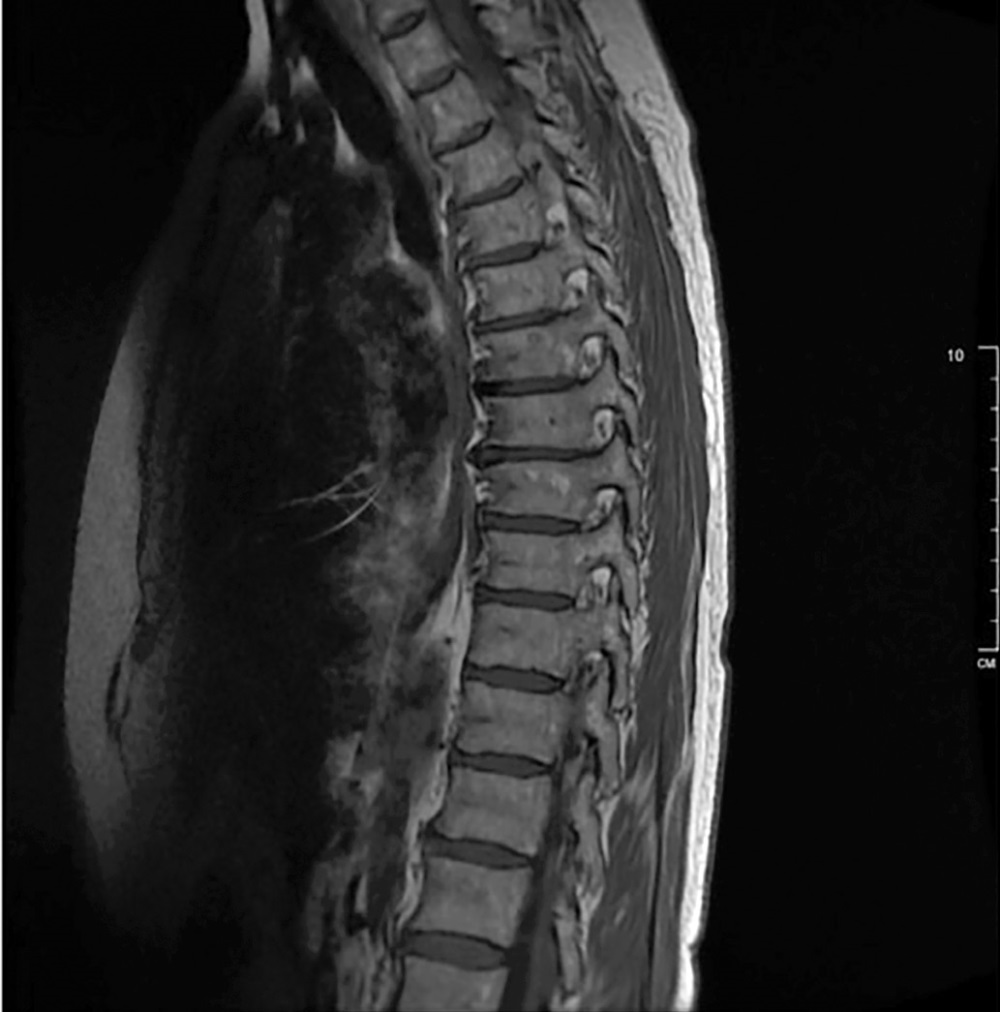
Рисунок 2. МРТ грудного отдела позвоночника.
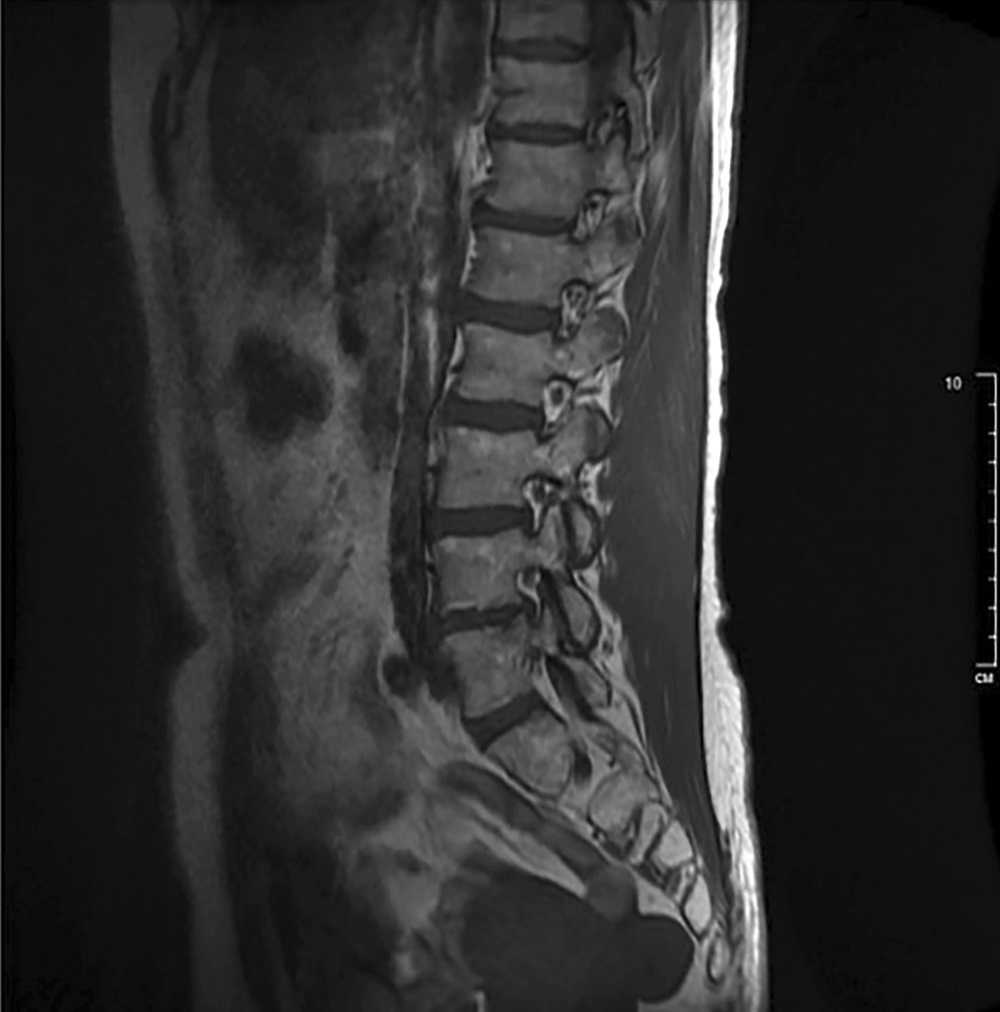
Рисунок 3. МРТ поясничного отдела позвоночника.
Для оценки толерантности к физической нагрузке проведен тест с 6-минутной ходьбой — дистанция составила 162,5 метра при нормальном значении от 450 метров.
Таким образом, анамнестические данные о переломе плюсневой кости и переломе бедра в возрасте 50 лет, значительное снижение функциональных возможностей (тест с 6-минутной ходьбой 162 м), многократное подтверждение сниженного уровня щелочной фосфатазы крови и гетерозиготная мутация в гене ALPL, для которой характерен доминантно-негативный эффект, позволяют верифицировать диагноз гипофосфатазии, в том числе согласно консенсусу о диагностике гипофосфатази у взрослых [26]. Пациентке рекомендована терапия препаратом асфотаза альфа, от которого ожидается эффект как для предупреждения новых патологических переломов, так и для восстановления ее функциональных возможностей.
ОБСУЖДЕНИЕ
Данный клинический случай подтверждает, что ГФФ взрослых по своему клинико-инструментальному проявлению имеет сходство с системным остеопорозом. Единственным отличием является низкий уровень ЩФ, который может быть ошибочно интерпретирован как проявление низкой интенсивности костного обмена. Следует помнить, что диагноз ГФФ не исключает развитие постменопаузального остеопороза. Так, у женщин в постменопаузе и у мужчин старше 50 лет в костной ткани, помимо типичных для гипофосфатазии нарушений нормального формирования гидроксиаппатита, могут происходить процессы избыточного разрушения костной ткани с потерей костной массы, нарушением микроархитектоники костной ткани, типичными для остеопороза [27]. При этом назначения бисфосфонатов в качестве терапии остеопороза могут способствовать дальнейшему снижению ЩФ и, возможно, усугублять течение гипофосфатазии, провоцируя в том числе атипичные переломы [25].
В литературе описаны схожие клинческие случаи. В одном случае больную длительно лечили альфакальцидолом и препаратами кальция по поводу ошибочного диагноза — постменопаузальный остеопороз, осложненный переломом тела позвонка, — хотя при обращении у пациентки отмечалось типичное для гипофосфатазии снижение уровня ЩФ. В другом случае у пациента с диагнозом «Асептический некроз головки бедренной кости» при обследовании на выявление отклонений метаболизма костной ткани (при асептическом некрозе возможны такие нарушения, и они требуют коррекции в до- и в послеоперационном периоде) выявлено резкое снижение уровня ЩФ [28]. В обоих случаях диагноз был подтвержден при генетическом исследовании. При этом выявленный генетический вариант как правило влияет на клиническую картину заболевания: так, при незначительной потере активности фермента у человека могут быть минимальные нарушения с развитием симптоматики по мере истощения активности фермента ЩФ. Различная степень потери активности ЩФ может объяснять широкую картину манифистации заболевания от минимальных проявлений до летальной формы с первыми проявлениями внутриутробно [26].
До недавнего времени единственно возможным методом лечения гипофосфатазии оставалась симптоматическая терапия. В 2008 г. был создан новый препарат с лабораторным кодом ENB0040, Asfotase Аlfa, зарегистрированный в октябре 2015 г. в США [29]. На сегодняшний день асфотаза альфа одобрена во многих странах, в том числе в России, для лечения гипофосфатазии. Асфотаза альфа (STRENSIG) представляет собой рекомбинантный белок, состоящий из внеклеточной части ТНЩФ, участка константного Fc-региона иммуноглобулина G1 человека и минералосвязывающего мотива дека-аспартата, направляющего рекомбинантный белок к поверхности кости [30]. В литературе есть сообщение об эффективности применения асфотазы альфа в случае позднего установления диагноза при детской форме [31]. Вместе с тем, хотя клинические исследования проводились при включении детской формы заболевания, пациенты с более мягким течением и условно взрослой формой могут получить пользу и полное восстановление от фермент-заместительной терапии асфотазой альфа [28]. Согласно консенсусу экспертов, опубликованному в 2023 г., данный клинический случай соответствует критериям диагностики взрослой формы гипофосфатазии (имеется стойкое снижение уровня ЩФ, патогенная мутация в гене ALPL, атипичный плохо заживающий перелом бедра, переломы плюсневых костей, снижение функциональных возможностей) [26]. Соответственно, мы можем ожидать предупреждения новых переломов и восстановление функциональных возможностей при назначении терапии. Вместе с тем, согласно инструкции к препарату, исследования проводились только при детской форме гипофосфатазии, и назначение препарата в данном случае должно производиться по врачебной комиссии.
ЗАКЛЮЧЕНИЕ
Гипофосфатазия является гетерогенным заболеванием с разной степенью тяжести, которое может поражать все возрастные группы. Нижние пределы уровней ЩФ, которые могут быть характерны для ГФФ, по-прежнему в значительной степени игнорируются, что затрудняет диагностику заболевания и установление его фактической распространенности среди населения. Для правильной интерпретации уровней ЩФ необходимо учитывать значения, характерные для возраста и пола пациента. Адекватное и своевременно начатое лечение гипофосфатазии имеет основополагающее значение, поскольку лекарственные препараты, обычно используемые для лечения других метаболических заболеваний костей, могут ухудшать ее течение.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Статья опубликована в рамках выполнения государственного задания №НИОКТР 124020700097-8 при финансовой поддержке Министерства здравоохранения Российской Федерации.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Пациенты добровольно подписали информированное согласие на публикацию персональной медицинской информации в обезличенной форме (именно в этом журнале).
Список литературы
1. Whyte MP. Hypophosphatasia - aetiology, nosology, pathogenesis, diagnosis and treatment. Nat Rev Endocrinol. 2016;12(4):233-46. doi: https://doi.org/10.1038/nrendo.2016.14
2. FRASER D. Hypophosphatasia. Am J Med. 1957;22(5):730-46. doi: https://doi.org/10.1016/0002-9343(57)90124-9
3. Mornet E, Yvard A, Taillandier A, Fauvert D, Simon-Bouy B. A molecular-based estimation of the prevalence of hypophosphatasia in the European population. Ann Hum Genet. 2011;75(3):439-45. doi: https://doi.org/10.1111/j.1469-1809.2011.00642.x
4. Mornet E, Yvard A, Taillandier A, Fauvert D, Simon-Bouy B. A molecular-based estimation of the prevalence of hypophosphatasia in the European population. Ann Hum Genet. 2011;75(3):439-45. doi: https://doi.org/10.1111/j.1469-1809.2011.00642.x
5. Mornet E, Taillandier A, Domingues C, Dufour A, Benaloun E, et al. Hypophosphatasia: a genetic-based nosology and new insights in genotype-phenotype correlation. Eur J Hum Genet. 2021;29(2):289-299. doi: https://doi.org/10.1038/s41431-020-00732-6
6. García-Fontana C, Villa-Suárez JM, Andújar-Vera F, González-Salvatierra S, Martínez-Navajas G, et al. Epidemiological, Clinical and Genetic Study of Hypophosphatasia in A Spanish Population: Identification of Two Novel Mutations in The Alpl Gene. Sci Rep. 2019;9(1):9569. doi: https://doi.org/10.1038/s41598-019-46004-2
7. Rathbun JC. Hypophosphatasia; a new developmental anomaly. Am J Dis Child. 1948. doi: https://doi.org/10.1001/archpedi.1948.02030020840003
8. Rockman-Greenberg C. Hypophosphatasia. Pediatr Endocrinol Rev. 2013;10(2):380-8
9. Bishop N. Clinical management of hypophosphatasia. Clin Cases Miner Bone Metab. 2015;12(2):170-3. doi: https://doi.org/10.11138/ccmbm/2015.12.2.170
10. Jemmerson R, Low MG. Phosphatidylinositol anchor of HeLa cell alkaline phosphatase. Biochemistry. 1987;26(18):5703-9. doi: https://doi.org/10.1021/bi00392a019
11. Seetharam B, Tiruppathi C, Alpers DH. Hydrophobic interactions of brush border alkaline phosphatases: the role of phosphatidyl inositol. Arch Biochem Biophys. 1987;253(1):189-98. doi: https://doi.org/10.1016/0003-9861(87)90651-5
12. Seefried L, Dahir K, Petryk A, Högler W, Linglart A, et al. Burden of Illness in Adults With Hypophosphatasia: Data From the Global Hypophosphatasia Patient Registry. J Bone Miner Res. 2020;35(11):2171-2178. doi: https://doi.org/10.1002/jbmr.4130
13. Whyte MP, Zhang F, Wenkert D, McAlister WH, Mack KE, et al. Hypophosphatasia: validation and expansion of the clinical nosology for children from 25 years experience with 173 pediatric patients. Bone. 2015;75:229-39. doi: https://doi.org/10.1016/j.bone.2015.02.022
14. Bianchi ML, Bishop NJ, Guañabens N, Hofmann C, Jakob F, et al. Hypophosphatasia in adolescents and adults: overview of diagnosis and treatment. Osteoporos Int. 2020;31(8):1445-1460. doi: https://doi.org/10.1007/s00198-020-05345-9
15. Whyte MP, Greenberg CR, Salman NJ, Bober MB, McAlister WH, et al. Enzyme-replacement therapy in life-threatening hypophosphatasia. N Engl J Med. 2012;366(10):904-13. doi: https://doi.org/10.1056/NEJMoa1106173
16. Baujat G, Michot C, Le Quan Sang KH, Cormier-Daire V. Perinatal and infantile hypophosphatasia: clinical features and treatment. Arch Pediatr. 2017;24(5S2):5S61-5S65. doi: https://doi.org/10.1016/S0929-693X(18)30016-2
17. Guguloth A, Aswani Y, Anandpara KM. Prenatal diagnosis of hypophosphatasia congenita using ultrasonography. Ultrasonography. 2016;35(1):83-6. doi: https://doi.org/10.14366/usg.15008
18. Rothenbuhler A, Linglart A. Hypophosphatasia in children and adolescents: clinical features and treatment. Arch Pediatr. 2017;24(5S2):5S66-5S70. doi: https://doi.org/10.1016/S0929-693X(18)30017-4
19. Conti F, Ciullini L, Pugliese G. Hypophosphatasia: clinical manifestation and burden of disease in adult patients. Clin Cases Miner Bone Metab. 2017;14(2):230-234. doi: https://doi.org/10.11138/ccmbm/2017.14.1.230
20. Bloch-Zupan A, Vaysse F. Hypophosphatasia: oral cavity and dental disorders. Arch Pediatr. 2017;24(5S2):5S80-5S84. doi: https://doi.org/10.1016/S0929-693X(18)30020-4
21. Sobel EH, Clark LC Jr, Fox RP, Robinow M. Rickets, deficiency of alkaline phosphatase activity and premature loss of teeth in childhood. Pediatrics. 1953;11(4):309-22
22. Chuck AJ, Pattrick MG, Hamilton E, Wilson R, Doherty M. Crystal deposition in hypophosphatasia: a reappraisal. Ann Rheum Dis. 1989;48(7):571-6. doi: https://doi.org/10.1136/ard.48.7.571
23. Koga M, Kinoshita Y, Kato H, Kobayashi H, Shinoda Y, et al. Massive calcification around large joints in a patient subsequently diagnosed with adult-onset hypophosphatasia. Osteoporos Int. 2022;33(2):505-509. doi: https://doi.org/10.1007/s00198-021-06145-5
24. Белая Ж.Е., Рожинская Л.Я.. Новые направления в терапии остеопороза - применение моноклональных человеческих антител к RANKL (Деносумаб) // Остеопороз и остеопатии. — 2011. — Т. 14. — № 2. — С. 23-26 doi: https://doi.org/10.14341/osteo2011223-26
25. Белая Ж.Е., Рожинская Л.Я. Бисфосфонаты в терапии постменопаузального остеопороза // Доктор.Ру. — 2010. — Т. 58. — № 7-2. — С. 29-38
26. Khan AA, Brandi ML, Rush ET, Ali DS, Al-Alwani H, et al. Hypophosphatasia diagnosis: current state of the art and proposed diagnostic criteria for children and adults. Osteoporos Int. 2024;35(3):431-438. doi: https://doi.org/10.1007/s00198-023-06844-1
27. Belaya Z, Rozhinskaya L, Dedov I, Drapkina O, Fadeev V, et al. A summary of the Russian clinical guidelines on the diagnosis and treatment of osteoporosis. Osteoporos Int. 2023;34(3):429-447. doi: https://doi.org/10.1007/s00198-022-06667-6
28. Родионова С.С., Захарова Е.Ю., Буклемишев Ю.В., Хакимов У.Р., Лапкина С.В. Гипофосфатазия у взрослых: клинические случаи и обзор литературы // Остеопороз и остеопатии. — 2015. — Т. 18. — №2. — С. 25-28. doi: https://doi.org/10.14341/osteo2015225-28
29. Alexion.com [Internet]. FDA Approves StrensiqTM (asfotase alfa) for Treatment of Patients with Perinatal-, Infantile- and Juvenile-Onset Hypophosphatasia (HPP). Available from: https://alexion.com/Documents/Strensiq_USPI
30. Khan AA, Josse R, Kannu P, Villeneuve J, Paul T, et al. Hypophosphatasia: Canadian update on diagnosis and management. Osteoporos Int. 2019;30(9):1713-1722. doi: https://doi.org/10.1007/s00198-019-04921-y
31. Калинченко Н.Ю., Голоунина О.О., Гребенникова Т.А., Мельниченко Г.А., Тюльпаков А.Н., Белая Ж.Е. Опыт клинического применения асфотазы альфа у молодого пациента с детской формой гипофосфатазии // Остеопороз и остеопатии. — 2019. — Т. 22. — №1. — С. 24-29. doi: https://doi.org/10.14341/osteo10136
Об авторах
С. Т. МагеррамоваРоссия
Магеррамова Сара Тофиковна - клинический ординатор.
117292, Москва, ул. Дмитрия Ульянова, д. 11
Конфликт интересов:
Нет
Ю. В. Тютюгина
Россия
Тютюгина Юлия Валерьевна - клинический ординатор.
117292, Москва, ул. Дмитрия Ульянова, д. 11
Конфликт интересов:
Нет
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна - д.м.н., заведующая отделением остеопороза и остеопатий.
Москва
AuthorID 583971
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Консолидированный перелом основания тела левой седалищной кости с деформацией подвздошно-седалищной борозды. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(195KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. МРТ грудного отдела позвоночника. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(123KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. МРТ поясничного отдела позвоночника. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(115KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Магеррамова С.Т., Тютюгина Ю.В., Белая Ж.Е. Диагностика гипофосфатазии во взрослом возрасте: клинические случаи и обзор литературы. Остеопороз и остеопатии. 2024;27(4):11-16. https://doi.org/10.14341/osteo13180
For citation:
Magerramova S.T., Tyutyugina Yu.V., Belaya Zh.E. Hypophosphatasia diagnosis in adults: clinical case and literature review. Osteoporosis and Bone Diseases. 2024;27(4):11-16. (In Russ.) https://doi.org/10.14341/osteo13180

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































