Перейти к:
Нарушения фосфорно-кальциевого обмена и тяжелое поражение скелета у пациентки с нейрофиброматозом 1 типа
https://doi.org/10.14341/osteo13182
Аннотация
Нейрофиброматоз 1 типа (НФ-1) — аутосомно-доминантное заболевание, обусловленное мутациями в гене NF1, кодирующем белок нейрофибромин. При мутациях в этом гене отсутствует подавление Ras-MAPK пути, что приводит к усилению пролиферации клеток и развитию опухолей. Помимо классических проявлений нейрофиброматоза (кожные проявления, опухоли периферических и черепно-мозговых нервов, сколиоз), у пациентов могут развиваться опухоли эндокринных желез: феохромоцитомы/параганглиомы и нейроэндокринные опухоли. Описаны случаи сочетания НФ-1 с акромегалией, опухолями надпочечников (в том числе с адренокортикальным раком), первичным гиперпаратиреозом (ПГПТ). Кроме того, НФ-1 примечателен развитием в редких случаях гипофосфатемической остеомаляции.
В статье представлено описание клинического случая сочетания у пациентки с НФ-1 с ПГПТ и гипофосфатемии, сохранявшейся после успешного хирургического лечения ПГПТ, и тяжелого поражения скелета с множественными позвоночными и внепозвоночными переломами, что было расценено как сочетание тяжелого остеопороза и гипофосфатемической остеомаляции. На фоне комбинированного лечения деносумабом, терипаратидом и альфакальцидолом достигнута положительная динамика минеральной костной плотности, нормализация уровня фосфора, однако сохраняется отсутствие консолидации перелома диафиза бедренной кости. В литературе имеются лишь единичные описания случаев сочетания НФ-1 одновременно с ПГПТ и гипофосфатемической остеомаляцией.
Ключевые слова
Для цитирования:
Мамедова Е.О., Колоколова Е.В., Бурякина С.А., Белая Ж.Е. Нарушения фосфорно-кальциевого обмена и тяжелое поражение скелета у пациентки с нейрофиброматозом 1 типа. Остеопороз и остеопатии. 2024;27(3):37-45. https://doi.org/10.14341/osteo13182
For citation:
Mamedova E.O., Kolokolova E.V., Buryakina S.A., Belaya Zh.E. Disturbances of mineral metabolism and severe skeletal involvement in a patient with neurofibromatosis type 1. Osteoporosis and Bone Diseases. 2024;27(3):37-45. (In Russ.) https://doi.org/10.14341/osteo13182
АКТУАЛЬНОСТЬ
Нейрофиброматоз 1 типа (НФ-1) — аутосомно-доминантное заболевание, обусловленное мутациями в гене NF1, ответственном за синтез белка нейрофибромина, который, в свою очередь, является опухолевым супрессором в Ras-MAPK пути. Соответственно, при мутации в NF1 отсутствует подавление Ras-MAPK пути, что приводит к усилению пролиферации клеток и развитию опухолей [1]. Распространенность НФ-1 в России составляет 1 на 2800–3300 населения [2].
НФ-1 диагностируется при наличии двух и более клинических критериев или при наличии гетерозиготного патогенного варианта в гене NF1. К клиническим критериям относят поражение кожного покрова: шесть и более пятен гиперпигментации кожи цвета «кофе с молоком» (>5 мм в допубертатном периоде и >15 мм в постпубертатном), веснушки в подмышечной или паховой области; опухоли периферических и черепно-мозговых нервов (2 или более нейрофибромы или одна плексиформная нейрофиброма, глиома зрительного нерва, 2 или более узелка Лиша радужки) и костные поражения (сколиоз, передне-латеральное искривление большеберцовой кости), а также наличие НФ-1 у родственника первой линии родства [3]. Чаще всего диагноз устанавливается в детском возрасте, однако при слабо выраженной клинической картине может быть пропущен.
Принимая во внимание, что НФ-1 является достаточно редким заболеванием и вызывает развитие опухолей, для эндокринологов особый интерес представляет его сочетание с образованиями эндокринных желез. Наиболее частыми эндокринными опухолями при НФ-1 являются феохромоцитомы/параганглиомы (встречаются в 2–6% случаев) и нейроэндокринные опухоли (менее 10% случаев) (чаще всего — соматостатиномы двенадцатиперстной кишки, также описаны инсулиномы, гастриномы и гормонально-неактивные нейроэндокринные опухоли поджелудочной железы) [4]. Также в литературе имеются данные о сочетании НФ-1 с опухолями надпочечников (в том числе с адренокортикальным раком), акромегалией и первичным гиперпаратиреозом (ПГПТ) [5–11]. Кроме того, НФ-1 примечателен развитием в редких случаях гипофосфатемической остеомаляции [12–14].
В статье представлен клинический случай сочетания НФ-1 и ПГПТ, гипофосфатемии/гипофосфатемической остеомаляции и тяжелого остеопороза у пациентки среднего возраста.
ОПИСАНИЕ СЛУЧАЯ
Пациентка П., 1961 г.р., впервые обратилась в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России в сентябре 2017 г. в возрасте 56 лет с жалобами на мышечную слабость, неспособность к самостоятельному передвижению, боль в левом плече, пояснице, иррадирующую в правую ногу. Из анамнеза известно о наличии гиперпигментированных пятен по типу «кофе с молоком» с рождения (рис. 1а). В целом пациентка считала себя здоровой до 48 лет, когда после наступления естественной менопаузы отметила появление единичных образований на коже с последующим увеличением их количества и размеров. С этого же возраста отметила появление болей в спине, а в последующем — постепенное уменьшение роста со 165 см на 35 см с формированием выраженной кифосколиотической деформации позвоночника. В возрасте 50–52 лет впервые возникли низкотравматичные переломы ребер. В 53 года произошел низкотравматичный перелом шейки правой бедренной кости с последующим эндопротезитованием. С начала июня 2017 г. пациентка отметила резкое ухудшение состояния, возникла выраженная мышечная слабость и трудности при ходьбе, в связи с чем начала передвигаться с помощью кресла-каталки. При осмотре: рост — 130 см, вес — 53 кг, индекс массы тела (ИМТ) — 31,3 кг/м². Обращали на себя внимание множественные образования кожи тела и конечностей по типу фибром и выраженный сколиоз (рис. 1б, в). Из семейного анамнеза имеются данные о наличии подобных кожных образований у брата и сына пациентки, отца и бабушки по отцовской линии. На момент поступления пациентка получала гипотензивную терапию по поводу гипертонической болезни, диагностированной около 10 лет назад, и препараты кальция в дозе 1000 мг/сут. В ходе госпитализации были выявлены гиперкальциемия и повышение уровня паратгормона, на основании чего диагностирован ПГПТ (табл. 1). При оценке осложнений ПГПТ, по результатам МСКТ позвоночника, выявлены множественные компрессионные переломы, консолидированные переломы 2–11 ребер слева, 1–3 и 7–12 ребер справа. Также отмечен грудной кифоз и выраженный S-образный сколиоз. По рентгеновской денситометрии диагностирован остеопороз с выраженным снижением минеральной плотности кости (МПК) (табл. 2). По УЗИ почек выявлены конкременты в обеих почках, максимально в диаметре до 0,5 см. По результатам топической диагностики при УЗИ — признаки объемного образования левой верхней околощитовидной железы размерами 2,1х1,3х1,5 см. Проведено хирургическое лечение ПГПТ, по данным морфологического исследования — аденома околощитовидной железы из оксифильных клеток. В послеоперационном периоде достигнута ремиссия ПГПТ (снижение ПТГ до 6,96 пг/мл и нормализация уровня общего кальция 2,27 ммоль/л (табл. 1), назначена терапия альфакальцидолом и препаратами кальция.

Рисунок 1. Кожные проявления у пациентки П.
а) пятна по типу «кофе с молоком», б) множественные нейрофибромы на коже живота, в) множественные нейрофибромы на коже спины.
Таблица 1. Показатели фосфорно-кальциевого обмена пациентки П. в динамике
Дата Показатель, единицы измерения | 2017 г. | 2017 г. | 2021 г. | 2021 г. | 2022 г. | 2023 г. | 2024 г. | Референсный интервал |
Кальций общий, ммоль/л | 2,61 | 2,36 | 2,41 | 2,43 | 2,38 | 2,36 | 2,44 | 2,15–2,55 |
Фосфор, ммоль/л | 0,48 | - | 0,94 | 0,72 | 0,6 | 0,91 | 0,80 | 0,74–1,52 |
ПТГ, пг/мл | 129,8 | 6,96 | 34,01 | - | 45,43 | 27,63 | 47,3 | 15–65 |
25(ОН)D, нг/мл | - | - | 57,1 | - | 32,1 | 33,9 | - | 33,9 |
ЩФ, Ед/л | 243 | - | 101 | 133 | 111 | 93 | 107 | 40–150 |
Остеокальцин, нг/мл | 42,84 | - | 18,22 | 19,9 | 15,66 | 13,15 | - | 11–43 |
β-cross-laps, нг/мл | 1,11 | - | 0,737 | 0,061 | 0,071 | 0,051 | - | 0,3–0,57 |
Креатинин, мкмоль/л | 50,3 | - | 72,3 | - | 68,3 | 60,9 | 73,0 | 50–98 |
TRP, % | - | - | - | - | 82 | 91,7 | 79,54 | 85–95 |
Таблица 2. Показатели денситометрии пациентки П. в динамике (Т-критерий, денситометр Lunar iDXA, GE)
Дата | L1-L4 | Total hip | Neck | Radius 33% | Radius total | ТКИ |
На фоне ПГПТ без лечения | ||||||
2017 г. | -6,3 | -4,7 | -2,5 | - | - | - |
На фоне ремиссии ПГПТ и терапии препаратами кальция, колекальциферолом и альфакальцидолом и инъекций деносумаба №4 | ||||||
2021 г. | -3,5 | -1,7 | 0,4 | -5,4 | - | - |
На терапии деносумабом (№6) + терипаратид (8 месяцев) + препараты кальция, колекальциферол и альфакальцилол | ||||||
2022 г. | -3,2 | -1,7 | 0,5 | - | - | 1,235 |
На терапии деносумабом (№8) + терипаратид (22,5 месяцев) + препараты кальция, колекальциферол и альфакальцилол | ||||||
2023 г. | -3,2 | -1,1 | 1,3 | -5,1 | -5,8 | - |
2024 г. | -3,1 | -1,5 | 0,1 | -5,5 | -6,1 | - |
В течение последующих 4 лет пациентка в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России не обращалась. Несмотря на проведенное хирургическое лечение и прием активных метаболитов витамина D и препаратов кальция, в отсутствие рецидива ПГПТ (табл. 1) произошли новые низкотравматичные переломы (левой плечевой кости в 2018 г. и нижней трети правой бедренной кости в 2019 г.), в связи с чем в 2019 г. по месту жительства была инициирована антирезорбтивная терапия деносумабом 60 мг подкожно 1 раз в 6 месяцев. На фоне лечения деносумабом была зафиксирована гипофосфатемия до 0,57 ммоль/л, в связи с чем очередная инъекция деносумаба была пропущена. В ходе повторной госпитализации в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России в мае 2021 г. (пропуск деносумаба в течение 9 месяцев) подтверждена ремиссия ПГПТ (табл. 1). Эндогенный гиперкортицизм как возможная причина тяжелого остеопороза был исключен (кортизол в вечерней слюне в пределах рефренсных значений — 2,31 нмоль/л (0,5–9,65)). По результатам денситометрии отмечалась выраженная положительная динамика по сравнению с исследованием от 2017 г. (табл. 2). По МРТ позвоночника данных за новые компрессионные переломы не получено (рис. 2а, б). В стационаре выполнена инъекция деносумаба, на фоне чего отмечалось снижение уровня фосфора до 0,72 ммоль/л (табл. 1). С учетом тяжелого остеопороза с множественными компрессионными переломами было принято решение к терапии деносумабом добавить терипаратид 20 мкг п/к ежедневно сроком на 2 года, а также альфакальцидол, продолжить терапию препаратами кальция и колекальциферолом.
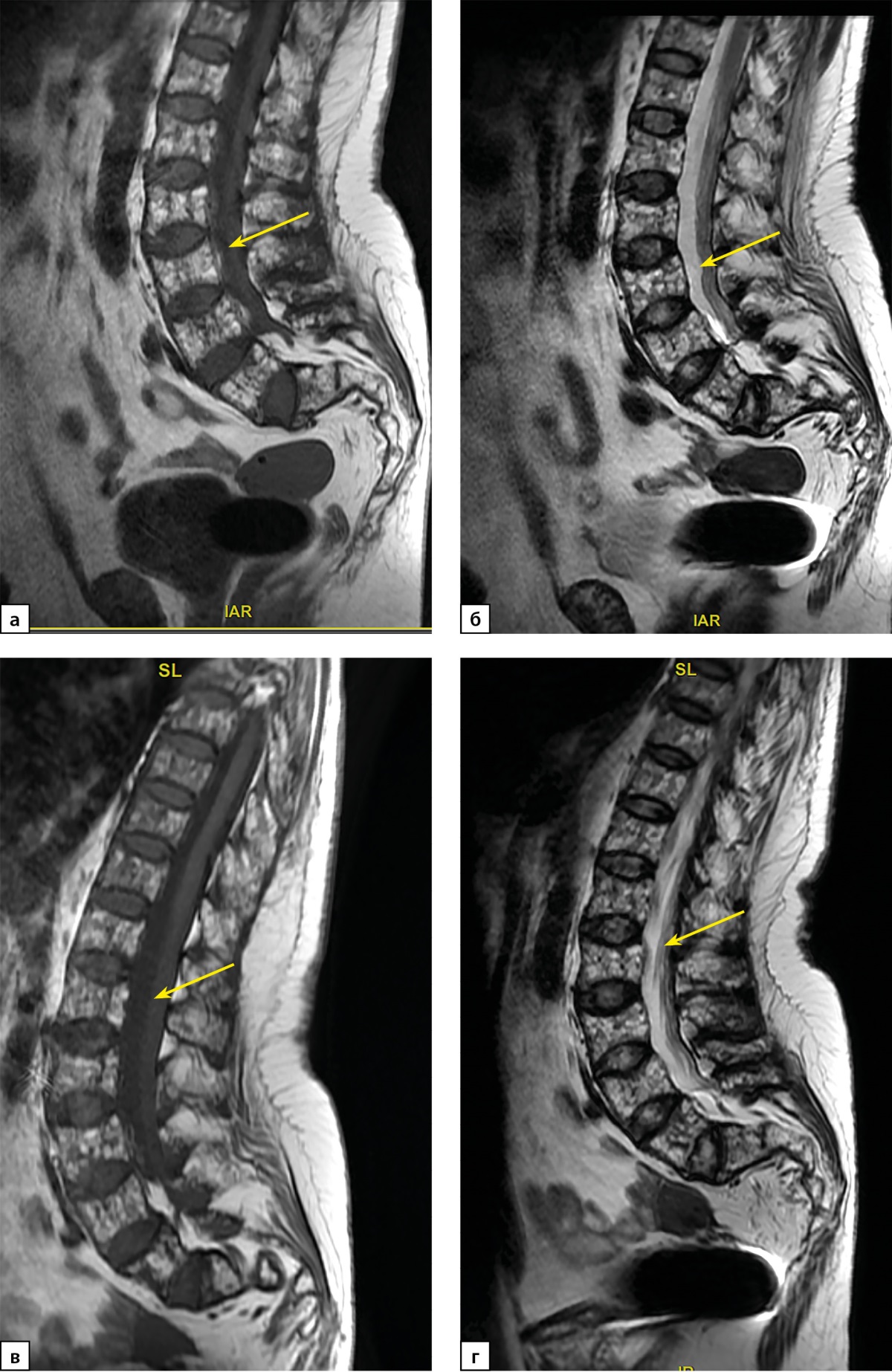
Рисунок 2. Пациентка П. МРТ-исследование поясничного отдела позвоночника в сагиттальной проекции:
а) МРТ от 2021 г. Т1 ВИ, б) МРТ от 2021 г. Т2 ВИ; в) МРТ от 2022 г. Т1 ВИ; г) МРТ от 2022 г. Т2 ВИ. Определяется выраженное (более 40%, 3 ст.) снижение высоты тел позвонков с формированием двояковогнутой их деформации («рыбьи позвонки»). МРТ-картина без динамики.
При госпитализации в 2022 г. на фоне терапии деносумабом, терипаратидом, альфакальцидолом 1 мкг/сут, препаратами кальция 1200 мг/сут, колекальциферолом 15000 МЕ/неделю вновь отмечена гипофосфатемия до 0,6 ммоль/л. Индекс реабсорбции фосфатов — 82% (85–95) (табл. 1). По данным денситометрии — динамика положительная, по ТКИ — без отрицательной динамики (табл. 2). По МРТ позвоночника — без динамики (рис. 2в, г). Принято решение о продолжении получаемой терапии сроком еще на один год. С учетом наличия множественных подкожных образований по типу фибром, отягощенного семейного анамнеза, тяжелого остеопороза, ПГПТ в анамнезе, эпизодов гипофосфатемии проведено полноэкзомное секвенирование (NextSeq550, Illumina, США). Выявлена герминальная гетерозиготная мутация со сдвигом рамки считывания в гене NF1 c.1541_1542del (p.Gln514fs), что подтвердило наличие у пациентки нейрофиброматоза 1 типа.
В 2023 г. на фоне терапии терипаратидом, деносумабом, альфакальцидолом, препаратами кальция и колекальциферола показатель фосфора в крови — в пределах референсного интервала, и индекс тубулярной реабсорбции фосфатов составил 91,7% (табл. 1). По данным денситометрии отмечалась положительная динамика в виде прироста МПК (табл. 2) и отсутствие новых компрессионных переломов по данным МСКТ грудного и поясничного отделов позвоночника (рис. 3а, б, рис. 4). Взят анализ крови на интактный фактор роста фибробластов 23 (ФРФ-23) (с помощью набора ELISA Biomedica BI-20700) — 30,143 пг/мл (по наблюдениям ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России, медиана у здоровых добровольцев 14,8 пг/мл, при ФРФ-23-продуцирующих опухолях — более 40 пг/мл (неопубликованные данные)).
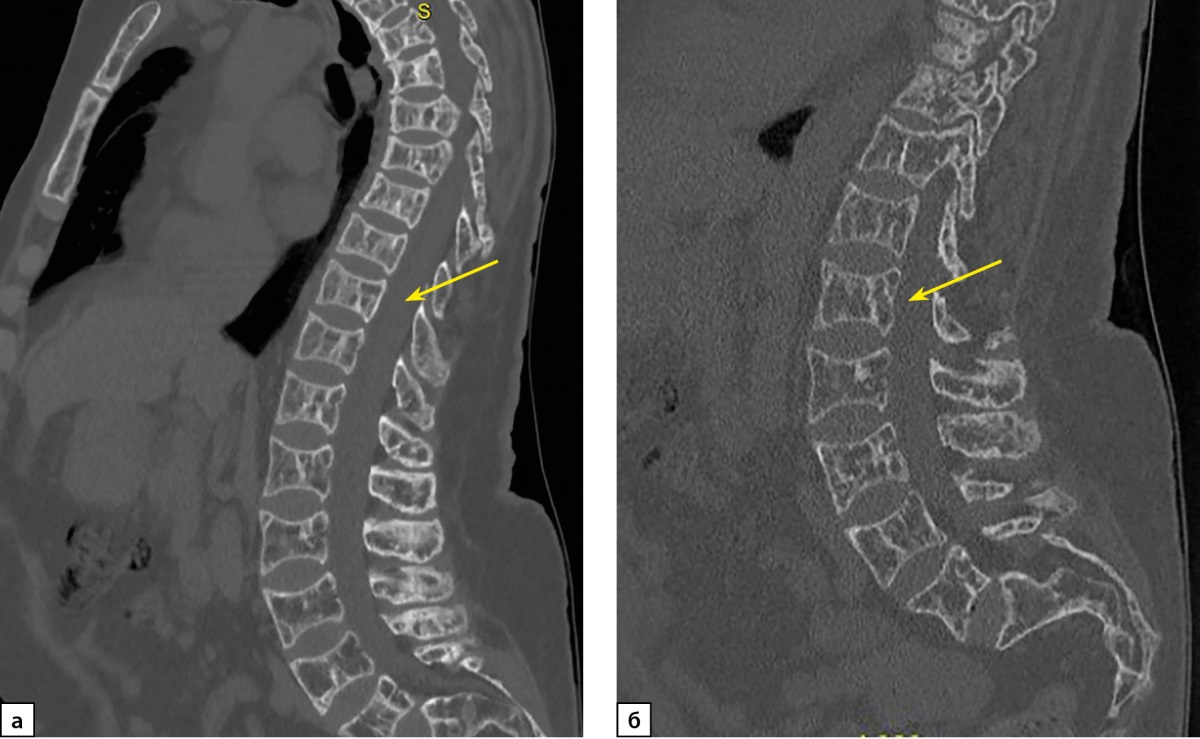
Рисунок 3. Пациентка П. КТ исследование позвоночника от 2023 г.
а) мультипланарная реконструкция, костный режим. Определяется выраженное (более 40%, 3 ст.) снижение высоты тел позвонков с формированием двояковогнутой их деформации («рыбьи позвонки»). Структура позвонков порозна, с участками кистовидной перестройки. Костные трабекулы утолщены. б) КТ-исследование поясничного отдела позвоночника, сагиттальная проекция. Определяется выраженное (более 40%, 3 ст.) снижение высоты тел позвонков с формированием двояковогнутой их деформации («рыбьи позвонки»). Структура позвонков порозна, с участками кистовидной перестройки. Костные трабекулы утолщены. КТ картина без динамики по сравнению с 2022 г.
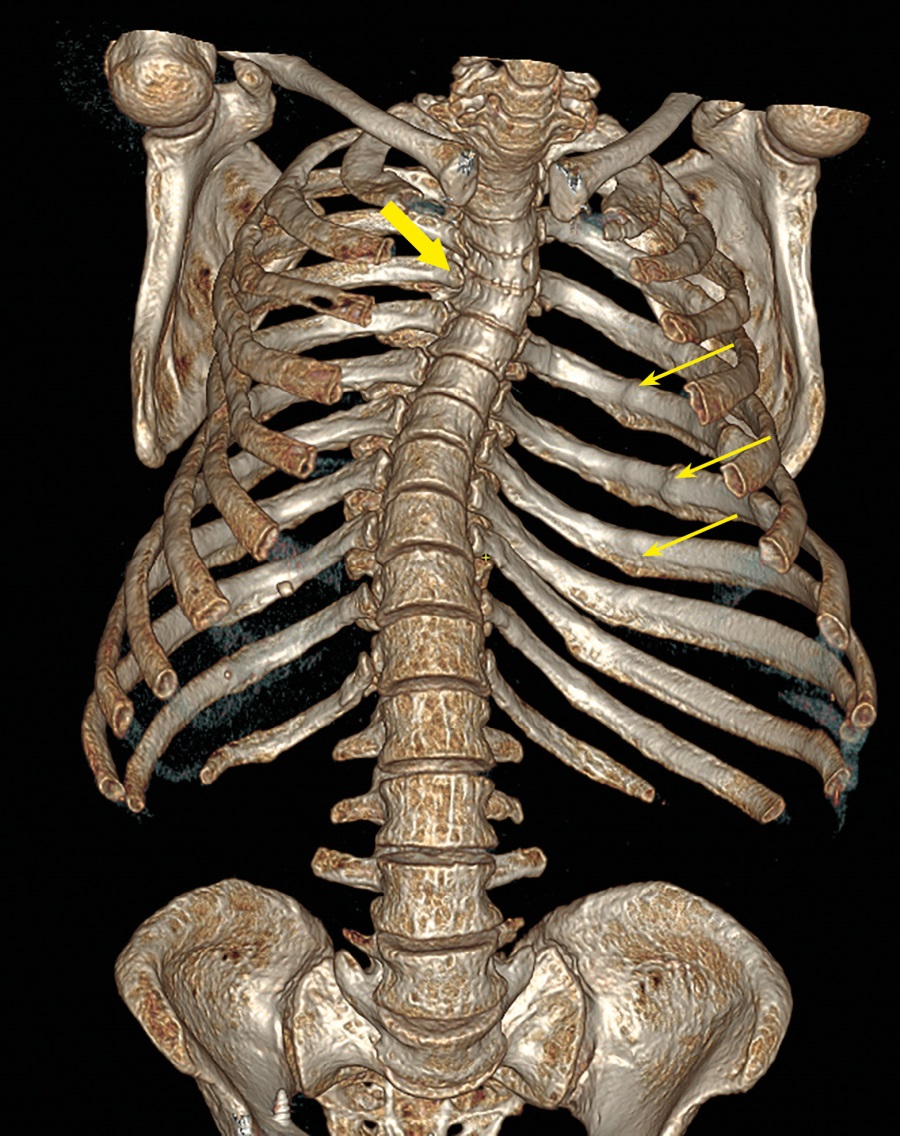
Рисунок 4. Пациентка П. КТ-исследование позвоночника от 2023 г. Трехмерная реконструкция.
Тонкие стрелки — консолидированные переломы ребер. Широкая стрелка — грудной кифоз и выраженный S-образный сколиоз.
В связи с отсутствием консолидации перелома нижней трети правой бедренной кости в августе 2023 г. проведена корригирующая остеотомия с фиксацией пластиной. По прошествии двух лет комбинированной терапии терипаратидом и деносумабом терипаратид отменен (последняя инъекция терипаратида — в декабре 2023 г.).
В июне 2024 г. на фоне терапии деносумабом, альфакальцидолом 1 мкг в сутки, препаратами кальция и колекальциферола при обследовании, по данным денситометрии, отмечалась умеренная отрицательная динамика МПК в лучевой кости и в проксимальном отделе бедренной кости, без существенной динамики в поясничном отделе позвоночника (табл. 2). По данным МСКТ позвоночника, при сравнении с 2023 г. — без значимых изменений. В связи с жалобами на боль в области правого бедра при попытке самостоятельного передвижения выполнена МСКТ, по данным которой выявлено отсутствие консолидации перелома нижней трети правой бедренной кости. По результатам лабораторных данных, подтверждена ремиссия ПГПТ, нормофосфатемия, однако сохраняется снижение индекса тубулярной реабсорбции фосфатов (79,54%), в связи с чем доза альфакальцидола увеличена до 1,5 мкг в сутки, а также, учитывая прием ингибиторов протонной помпы, карбонат кальция заменен на цитрат кальция. Терапия деносумабом и колекальциферолом продолжена. Травматологами предложено продолжить динамическое наблюдение за процессом консолидации перелома бедренной кости без активного хирургического вмешательства.
Помимо перечисленных нарушений у пациентки также обращал на себя внимание длительный анамнез нестерпимой головной боли с неудовлетворительным эффектом от постоянной терапии НПВС и трамадолом (100 мг 3 раза в сутки). По данным МРТ головы в 2021 и 2023 гг., данных за объемные образования не получено. В связи с наличием генетически подтвержденного НФ-1 была проведена МСКТ органов брюшной полости и забрюшинного пространства, данных за объемные образования получено не было.
ОБСУЖДЕНИЕ
Особенностью представленного клинического случая является сочетание нарушений фосфорно-кальциевого обмена (ПГПТ, гипофосфатемии) и тяжелого поражения скелета с множественными переломами у пациентки с НФ-1.
НФ-1 считается заболеванием, ассоциированным с производными из клеток нервного гребня, а поскольку главные клетки околощитовидных желез происходят также из нервного гребня, можно предположить связь НФ-1 и ПГПТ [15]. Тем не менее существующие данные не подтверждают эту гипотезу. Ретроспективное исследование 1404 пациентов с НФ-1 в Финляндии не выявило ни одного случая ПГПТ [16], а проспективное исследование 448 пациентов в Великобритании выявило лишь 1 случай [17]. В ретроспективном исследовании во Франции среди 108 пациентов с НФ-1 у 24 (22,2%) была выявлена феохромоцитома (односторонняя в 65,5%), у 3 (2,8%) — гастроэнтеропанкреатические нейроэндокринные опухоли, у 4 (3,7%) — гастроинтестинальные стромальные опухоли, и только у одной пациентки — ПГПТ [18]. Таким образом, можно сделать вывод, что ПГПТ не является классическим компонентом НФ-1, в отличие от некоторых других эндокринных опухолей, таких как феохромоцитомы, параганглиомы, нейроэндокринные опухоли. Тем не менее сочетание НФ-1 с ПГПТ встречается, но достаточно редко: в литературе описано менее 40 случаев [15][19–21]. В 2017 г. Triggiani et al. обобщили данные 32 опубликованных на тот момент случаев сочетания ПГПТ и НФ-1 [15]. Из них было 17 женщин, средний возраст на момент диагноза ПГПТ — 52 года (минимальный возраст — 18 лет, максимальный — 71 год). По гистологическому исследованию у 21 пациента была выявлена аденома ОЩЖ, у 2 — атипичная аденома ОЩЖ, у 2 — гиперплазия четырех ОЩЖ, у 1 — рак ОЩЖ [15], что в целом соответствует статистике в общей популяции. Клинически более тяжелое течение отмечается при манифестации ПГПТ в молодом возрасте [19] и более мягкое течение у женщин в постменопаузе [22][23]. Рецидивирующее течение ПГПТ после хирургического лечения при НФ-1 в литературе не описано. Также имеются данные о сочетании НФ-1 типа не только с ПГПТ, а также одновременно с ПГПТ и феохромоцитомой [24] и ПГПТ, феохромоцитомой и акромегалией [25]. С исторической точки зрения примечательно, что и НФ-1, и фиброзно-кистозный остеит в рамках ПГПТ имели название болезни Реклингхаузена [26][27].
Крайне редко при НФ-1 встречается гипофосфатемия и гипофосфатемическая остеомаляция: в литературе описано около 40 случаев [12]. У пациентов с НФ-1 и гипофосфатемией отмечается снижение индекса тубулярной реабсорбции фосфатов, что свидетельствует об избыточной потере фосфора с мочой [12][13]. В ряде случаев отмечено повышение уровня ФРФ-23 [12][14], тогда как в других случаях его уровень был в норме или незначительно выше нормы [28][29], однако источник гиперпродукции ФРФ-23 при НФ-1 остается неясен. Предполагалось, что таким источником могут быть нейрофибромы, а сам НФ-1 ряд авторов объединяет в одну группу с кожно-скелетным синдромом с гипофосфатемией (вследствие соматических мутаций в генах цепи RAS (HRAS, NRAS, KRAS) и синдромом МакКьюна-Олбрайта-Брайцева (вследствие соматических мутаций в гене GNAS), при которых также может развиваться гипофосфатемия и кожные проявления (невусы, пятна «кофе с молоком») [28][30]. В работе Jagtap et al. у 3 пациентов с НФ-1 позитронно-эмиссионная томография в 18F-дезоксиглюкозой показала повышенный захват радиофармпрепарата одной из наибольших по размеру нейрофибром, однако удаление такой крупной нейрофибромы у одного из пациентов не привело к нормализации уровня фосфора [28]. Obo et al. описали клинический случай пациентки с НФ-1 и гипофосфатемической остеомаляцией, при этом две крупные нейрофибромы накапливали 111In-пентетреотид при сцинтиграфии [14]. Однако удаление этих нейрофибром также не привело к нормализации уровня фосфора и ФРФ-23 в крови, а сама нейрофиброма не имела положительного окрашивания на ФРФ-23 при иммуногистохимическом исследовании [14]. Sahoo et al. также провели иммуногистохимическое исследование ткани удаленной нейрофибромы с антителами к ФРФ-23 у пациентки с НФ-1 и гипофосфатемией, однако окрашивания на ФРФ-23 не было обнаружено [12]. В исследовании Kamiya et al. на мышиной модели с нокаутом гена Nf1 было продемонстрировано повышение уровня ФРФ-23 в крови в 4 раза по сравнению с контролем [31]. Кроме того, экспрессия мРНК ФРФ-23 из остеоцитов бедренной кости таких мышей была в 8 раз выше по сравнению с клеточной линией контроля, что позволило авторам сделать вывод, что именно кость является источником гиперпродукции ФРФ-23 при НФ-1 [31]. Сочетания НФ-1, ПГПТ и гипофосфатемической остеомаляции также были описаны в литературе [32].
У нашей пациентки гипофосфатемия исходно была расценена как проявление ПГПТ, однако при ретроспективном анализе обращало на себя внимание несоответствие выраженности снижения уровня фосфора (0,48 ммоль/л) уровню ПТГ (129,8 пг/мл). Повторно гипофосфатемия была зафиксирована после инициации терапии деносумабом. Введение деносумаба может приводить к гипофосфатемии, что может быть обусловлено развитием гипокальциемии и компенсаторным повышением ПТГ [33]. Однако у пациентки в представленном клиническом случае на протяжении всего динамического наблюдения уровень ПТГ после хирургического лечения сохранялся в пределах референсных значений. В связи с сохранением гипофосфатемии после достижения стойкой ремиссии ПГПТ (эпизоды гипофосфатемии до 0,6 ммоль/л, снижение индекса тубулярной реабсорбции на фоне лечения альфакальцидолом (до 79,5%)) был измерен уровень ФРФ-23, по результатам его уровень был выше по сравнению с группой здоровых добровольцев, однако не соответствовал уровню при опухоль-индуцированной остеомаляции. Таким образом, генез развития гипофосфатемии в представленном случае, наиболее вероятно, связан с гиперпродукцией ФРФ-23 и обусловлен основным заболеванием — НФ-1. В связи с нормализацией уровня фосфора на фоне приема альфакальцидола было принято решение продолжить эту терапию. Существует единичное описание применение буросумаба у пациентки с НФ-1, гипофосфатемией и остеомаляцией, (доказанной проведением костной биопсии), приведшее к нормализации уровня фосфора в крови [34].
НФ-1 характеризуется поражением скелета, встречающемся в около 70% случаев и включающем остеопороз, кифосколиоз, низкий рост, макроцефалию, деформации грудной клетки, дисплазию крыла клиновидной кости и псевдоартроз большеберцовой кости [35]. По некоторым данным, у пациентов с НФ-1 выше частота переломов по сравнению с группами контроля [36]. У нашей пациентки имеется тяжелое поражение скелета — выраженный кифосколиоз, а также множественные позвоночные и внепозвоночные переломы и выраженное снижение МПК. Изначально костное поражение было расценено нами только как проявления остеопороза смешанного генеза (постменопаузального, гиперпаратиреоидного), однако, с учетом результатов исследования уровня ФРФ-23 и фиксировавшейся периодически гипофосфатемии, нельзя исключить наличие у пациентки и остеомаляции. В связи с невозможностью проведения костной биопсии для подтверждения остеомаляции, а также в связи с нормализацией уровня фосфора на фоне терапии альфакальцидолом, нормальным уровнем щелочной фосфатазы, вопрос о назначении незарегистрированного в РФ препарата буросумаб в настоящее время отложен. В целом на фоне лечения пациентки деносумабом и терипаратидом отмечено улучшение показателей МПК, отсутствие новых переломов, однако сохраняется отсутствие консолидации перелома бедренной кости. Сложности лечения остеопороза при НФ-1 заключаются в том, что применение деносумаба может усугубить имеющуюся гипофосфатемию, а применение бисфосфонатов противопоказано при подозрении на сопутствующую остеомаляцию.
ЗАКЛЮЧЕНИЕ
Таким образом, в представленном клиническом случае у пациентки с НФ-1 отмечено сочетание ПГПТ, гипофосфатемии (и, предположительно, остеомаляции) и тяжелого остеопороза. Многие вопросы, связанные с эндокринными нарушениями при НФ-1, остаются малоизученными: развивается ли ПГПТ в рамках НФ-1 или является случайным сочетанием двух заболеваний; каков механизм развития гипофосфатемии у пациентов с НФ-1 и эффективна ли терапия буросумабом у таких пациентов; какова оптимальная тактика лечения при сочетании остеопороза и остеомаляции? В целом, изучение редких заболеваний, ассоциированных с нарушениями костного и фосфорно-кальциевого обмена, позволит улучшить понимание механизмов, приводящих к их возникновению.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена в рамках государственного задания «Новые технологии диагностики и дифференциальной диагностики первичного и вторичного остеопороза на фоне эндокринопатий и орфанных заболеваний скелета» № 124020700097-8.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Согласие пациента. Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Остеопороз и остеопатии».
Список литературы
1. Lobbous N, Bernstock N, Coffee N, et al. An update on neurofibromatosis Type 1-Associated Gliomas. Cancers. 2020;12(1):114. doi: https://doi.org/10.3390/cancers12010114
2. Пахомова Д.К., Дундукова Р.С., Кужина Д.Т., и др. Распространенность нейрофиброматоза 1 типа и значение мероприятий для его раннего выявления // International Scientific And Practical Conference World Science. — 2017. — Т. 5. — №21. — С. 22-24.
3. Friedman JM. Neurofibromatosis 1. In: Adam MP, Mirzaa GM, Pagon RA, et al., eds. GeneReviews®. NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK1109/. Published September 8, 1998. Updated July 6, 2023
4. Kalkan E, Waguespack SG. Endocrine tumors associated with neurofibromatosis type 1, Peutz-Jeghers syndrome and other familial neoplasia syndromes. Front Horm Res. 2013;41:166-181. doi: https://doi.org/10.1159/000345676
5. Юкина М.Ю., Авсиевич Е.С., Пушкарева А.С., Нуралиева Н.Ф., Бондаренко Е.В., и др. Атипичное и типичное течение нейрофиброматоза 1 типа в сочетании с феохромоцитомой // Эндокринная хирургия. — 2021. — Т. 15. — №3. — С. 30-40. doi: https://doi.org/10.14341/serg12730
6. Sandru F, Carsote M, Valea A, Albu SE, Petca RC, Dumitrascu MC. Somatostatinoma: Beyond neurofibromatosis type 1 (Review). Exp Ther Med. 2020;20(4):3383-3388. doi: https://doi.org/10.3892/etm.2020.8965
7. Najafi-Semnani M, Rajabi-Moghaddam M, Abbaszadeh H. Adrenocortical carcinoma in a patient with neurofibromatosis type 1: A case report. Caspian J Intern Med. 2021;12(4):613-617. doi: https://doi.org/10.22088/cjim.12.4.613
8. James AW, Chang L, Genshaft S, Dry SM. Coincident liposarcoma, carcinoid and gastrointestinal stromal tumor complicating type 1 neurofibromatosis: Case report and literature review. J Orthop. 2014;12(Suppl 1):S111-S116. doi: https://doi.org/10.1016/j.jor.2014.08.010
9. Massironi S, Zilli A, Rossi RE, Cavalcoli F, Conte D, Peracchi M. Gastrinoma and neurofibromatosis type 2: the first case report and review of the literature. BMC Gastroenterol. 2014;14:110. doi: https://doi.org/10.1186/1471-230X-14-110
10. Al-Wahhabi B. Parathyroid adenoma and bilateral pheochromocytoma in a patient with neurofibromatosis. Ann Saudi Med. 2005;25(3):255-257. doi: https://doi.org/10.5144/0256-4947.2005.255
11. Behera KK, Nanaiah A, Gupta A, Rajaratnam S. Neurofibromatosis type 1, pheochromocytoma with primary hyperparathyroidism: A rare association. Indian J Endocrinol Metab. 2013;17(2):349-351. doi: https://doi.org/10.4103/2230-8210.109670
12. Sahoo SK, Shah S, Gupta P. Elevated FGF23 in a patient with hypophosphatemic osteomalacia associated with neurofibromatosis type 1. Bone. 2019;123:144-148. doi: https://doi.org/10.1016/j.bone.2019.03.018
13. Gupta A, Dwivedi A, Patel P, Gupta S. Hypophosphatemic osteomalacia in von Recklinghausen neurofibromatosis: Case report and literature review. Indian J Radiol Imaging. 2015;25(1):63-66. doi: https://doi.org/10.4103/0971-3026.150155
14. Obo T, Koriyama N, Tokito A, Ogiso K, Nishio Y. Neurofibromatosis type 1 associated with hypophosphatemic osteomalacia due to hypersecretion of fibroblast growth factor 23: A case report. J Med Case Rep. 2020;14:208. doi: https://doi.org/10.1186/s13256-020-02381-1
15. Triggiani V, Castellana M, Basile P, Renzulli G, Giagulli VA. Parathyroid carcinoma causing mild hyperparathyroidism in neurofibromatosis type 1: A case report and systematic review. Endocr Metab Immune Disord Drug Targets. 2019;19(3):382-388. doi: https://doi.org/10.2174/1871530318666180910123316
16. Uusitalo E, Rantanen M, Kallionpää RA, et al. Distinctive cancer associations in patients with neurofibromatosis type 1. J Clin Oncol. 2016;34(17):1978-1986. doi: https://doi.org/10.1200/JCO.2015.65.3576
17. Walker L, Thompson D, Easton D, et al. A prospective study of neurofibromatosis type 1 cancer incidence in the UK. Br J Cancer. 2006;95(2):233-238. doi: https://doi.org/10.1038/sj.bjc.6603227
18. Dupuis H, Chevalier B, Cardot-Bauters C, Jannin A et al. Prevalence of endocrine manifestations and GIST in 108 systematically screened patients with neurofibromatosis type 1. J Endocr Soc. 2023;7:1-11. doi: https://doi.org/10.1210/jendso/bvad083
19. Al-Wahhabi B. Parathyroid adenoma and bilateral pheochromocytoma in a patient with neurofibromatosis. Ann Saudi Med. 2005;25(3):255-257. doi: https://doi.org/10.5144/0256-4947.2005.255
20. Behera KK, Nanaiah A, Gupta A, Rajaratnam S. Neurofibromatosis type 1, pheochromocytoma with primary hyperparathyroidism: A rare association. Indian J Endocrinol Metab. 2013;17(2):349-351. doi: https://doi.org/10.4103/2230-8210.109670
21. Demirjian AN, Grossman JM, Chan JL, Parangi S. Parathyroid carcinoma and neurofibromatosis. Surgery. 2008;144(5):827-829. doi: https://doi.org/10.1016/j.surg.2008.07.015
22. Bahadir C, Gürleyik G, Ocak E. Neurofibromatosis type 1 and primary hyperparathyroidism with spinal deformity and osteoporosis. Acta Chir Belg. 2009;109(1):123-125. doi: https://doi.org/10.1080/00015458.2009.11680390
23. Yamamoto Y, Kodama K, Yokoyama S, Takeda M, Michishita S. A pleural solitary fibrous tumor, multiple gastrointestinal stromal tumors, Moyamoya disease, and hyperparathyroidism in a patient associated with NF1. Case Rep Surg. 2015;2015:375416. doi: https://doi.org/10.1155/2015/375416
24. Рябченко Е.В., Дремлюга Н.В., Межинская Е.М., Полянский Е.А. Феохромоцитома в сочетании с первичным гиперпаратиреозом и нейрофиброматозом типа 1. Хирургия. Журнал им. Н.И. Пирогова. — 2023. — №7. — 120-127. doi: https://doi.org/10.17116/hirurgia2023071120
25. Yasuda S, Inoue I, Shimada A. Neurofibromatosis type 1 with concurrent multiple endocrine disorders: Adenomatous goiter, primary hyperparathyroidism, and acromegaly. Internal Medicine. 2021;60(15):2451-2459. doi: https://doi.org/10.2169/internalmedicine.4981-20
26. Rad SN, Anastasopoulou C, Barnett MJ, Deluxe L. Osteitis fibrosa cystica. StatPearls - NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK559097/. Published November 12, 2023
27. Adil A, Koritala T, Munakomi S, Singh AK. Neurofibromatosis type 1. StatPearls - NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK459358/. Published August 13, 2023
28. Jagtap VS, Sarathi V, Lila AR, Bandgar TR, Menon PS, Shah NS. The clinical, biochemical, and radiological profile of Indian patients with fibrous dysplasia and McCune-Albright syndrome. J Postgrad Med. 2011;57(3):180-185. doi: https://doi.org/10.4103/0022-3859.85213
29. Liu Y, Zhang Z, Liang M, Liu Y, Zhang N, Xu K. Comprehensive imaging analysis of a patient with neurofibromatosis type 1 combined with hypophosphatemic osteomalacia: A case description. Quant Imaging Med Surg. 2023;13(7):4777-4784. doi: https://doi.org/10.21037/qims-22-1217
30. Folpe AL. Phosphaturic mesenchymal tumors: A review and update. Semin Diagn Pathol. 2019;36(4):260-268. doi: https://doi.org/10.1053/j.semdp.2019.07.002
31. Kamiya N, Yamaguchi R, Aruwajoye O, et al. Targeted disruption of NF1 in osteocytes increases FGF23 and osteoid with osteomalacia-like bone phenotype. J Bone Miner Res. 2017;32(8):1716-1726. doi: https://doi.org/10.1002/jbmr.3155
32. Weinstein RS, Harris RL. Hyperparathyroidism and osteomalacia in neurofibromatosis. Am J Med. 1982;73(2):369-374. doi: https://doi.org/10.1016/0002-9343(82)90502-7
33. Megapanou E, Florentin M, Milionis H, Elisaf M, Liamis G. Drug-induced hypophosphatemia: Current insights. Drug Saf. 2019;43(3):197-210. doi: https://doi.org/10.1007/s40264-019-00888-1
34. Calabria A. Use of burosumab in the treatment of hypophosphatemic osteomalacia in neurofibromatosis type 1: A rare case with a novel treatment. P89. ICCBH 11th International Conference on Children’s Bone Health, 22-25 June 2024
35. Rhodes JS, Wu F, Hunter CJ. Multidisciplinary approach to osteomalacia: A review. J Clin Endocrinol Metab. 2020;105(5):1459-1474. doi: https://doi.org/10.1210/clinem/dgz166
36. Tucker T, Schnabel C, Hartmann M, et al. Bone health and fracture rate in individuals with neurofibromatosis 1 (NF1). J Med Genet. 2009;46(4):259-265. doi: https://doi.org/10.1136/jmg.2008.061895
Об авторах
Е. О. МамедоваРоссия
Мамедова Елизавета Октаевна - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. В. Колоколова
Россия
Колоколова Екатерина Владимировна - клинический ординатор.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
С. А. Бурякина
Россия
Бурякина Светлана Алексеевна - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна - д.м.н., профессор.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Кожные проявления у пациентки П. а) пятна по типу «кофе с молоком», б) множественные нейрофибромы на коже живота, в) множественные нейрофибромы на коже спины. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(221KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Пациентка П. МРТ-исследование поясничного отдела позвоночника в сагиттальной проекции: а) МРТ от 2021 г. Т1 ВИ, б) МРТ от 2021 г. Т2 ВИ; в) МРТ от 2022 г. Т1 ВИ; г) МРТ от 2022 г. Т2 ВИ. Определяется выраженное (более 40%, 3 ст.) снижение высоты тел позвонков с формированием двояковогнутой их деформации («рыбьи позвонки»). МРТ-картина без динамики. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(627KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Пациентка П. КТ исследование позвоночника от 2023 г. а) мультипланарная реконструкция, костный режим. Определяется выраженное (более 40%, 3 ст.) снижение высоты тел позвонков с формированием двояковогнутой их деформации («рыбьи позвонки»). Структура позвонков порозна, с участками кистовидной перестройки. Костные трабекулы утолщены. б) КТ-исследование поясничного отдела позвоночника, сагиттальная проекция. Определяется выраженное (более 40%, 3 ст.) снижение высоты тел позвонков с формированием двояковогнутой их деформации («рыбьи позвонки»). Структура позвонков порозна, с участками кистовидной перестройки. Костные трабекулы утолщены. КТ картина без динамики по сравнению с 2022 г. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(291KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Пациентка П. КТ-исследование позвоночника от 2023 г. Трехмерная реконструкция. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(664KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Мамедова Е.О., Колоколова Е.В., Бурякина С.А., Белая Ж.Е. Нарушения фосфорно-кальциевого обмена и тяжелое поражение скелета у пациентки с нейрофиброматозом 1 типа. Остеопороз и остеопатии. 2024;27(3):37-45. https://doi.org/10.14341/osteo13182
For citation:
Mamedova E.O., Kolokolova E.V., Buryakina S.A., Belaya Zh.E. Disturbances of mineral metabolism and severe skeletal involvement in a patient with neurofibromatosis type 1. Osteoporosis and Bone Diseases. 2024;27(3):37-45. (In Russ.) https://doi.org/10.14341/osteo13182

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































