Оригинальное исследование
ОБОСНОВАНИЕ. Несовершенный остеогенез (МКБ10 Q78.0) и синдром Элерса-Данло (МКБ10 Q79.6) представляют собой редкие наследственные (орфанные) заболевания соединительной ткани с вариабельными клиническими проявлениями и широким спектром молекулярных дефектов. Данные о распространенности этих заболеваний фрагментарны вследствие гетерогенной клинической картины и низкой доступности молекулярной диагностики, как в мире, так и в России. Вместе с тем понимание частоты встречаемости этих заболеваний может помочь оптимизировать диагностику и повысить качество оказания медицинской помощи данной категории пациентов.
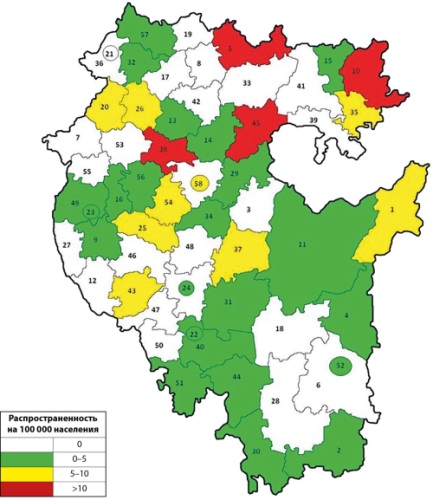
ЦЕЛЬ. Провести анализ распространенности несовершенного остеогенеза и синдрома Элерса-Данло в Республике Башкортостан — по данным медицинской документации.
МАТЕРИАЛЫ И МЕТОДЫ. Данные о численности населения республики получены на официальном сайте Территориального органа Федеральной службы государственной статистики по Республике Башкортостан. Информация о частоте встречаемости заболеваний взята на основе отчетов ГКУЗ РБ Медицинский информационно-аналитический центр, анализа картотеки ГБУЗ Республиканский медико-генетический центр (г. Уфа) и анализа Республиканской медицинской информационно-аналитической системы «ПроМед». Молекулярно-генетические исследования проводились методом массового параллельного секвенирования.
РЕЗУЛЬТАТЫ. Всего в Республике Башкортостан было выявлено 199 пациентов с несовершенным остеогенезом (НО), из них находятся под активным наблюдением 69 (34,6%) пациентов. Молекулярно-генетическое исследование проведено для 64 пациентов (32,1%), при этом выявлено 16 патогенных изменений в гене COL1A1, 11 патогенных мутаций в гене COL1A2, по одной мутации в генах P3H1 и IFITM5. Мужчин выявлено 112, женщин — 87 человек. Доля пациентов младше 18 лет в целом по республике составила 36,1%. В Уфе зарегистрировано 80 пациентов, процент находящихся под активным наблюдением составил 42,5%. В целом в Республике Башкортостан зарегистрировано 133 пациента с синдромом Элерса-Данло, из них под активным наблюдением — 30 пациентов (22,5%). Молекулярно-генетическое исследование проведено для 43 пациентов (32,3%), при этом выявлено 5 изменений нуклеотидной последовательности в гене COL5A1 и 3 — в гене COL5A2. Мужчин в целом по республике 71 человек, женщин — 62. Как и в случае с НО, преобладают пациенты старше 18 лет — их 89 человек (66,9%), под активным наблюдением из них 18 пациентов (28,6%). Общая распространенность НО в Республике Башкортостан составила 5,031 случая на 100 тыс. населения, синдрома Элерса-Данло — 3,362 случая на 100 тыс. населения. Пациенты с несовершенным остеогенезом чаще находятся под активным наблюдением по сравнению с имеющими синдром Элерса-Данло (48,6 и 22,5% соответственно), что объясняется более длительным периодом работы с этой группой больных.
ЗАКЛЮЧЕНИЕ. Определена распространенность НО и синдрома Элерса-Данло в Республике Башкортостан по данным медицинской документации. Общая распространенность НО в Республике Башкортостан составила 5,031 случая на 100 тыс. населения, синдрома Элерса-Данло — 3,362 случая на 100 тыс. населения.
ОБОСНОВАНИЕ. Системная красная волчанка (СКВ) — хроническое заболевание неизвестной этиологии, характеризующееся системным иммуновоспалительным поражением жизненно важных органов. Тяжелым осложнением СКВ являются асептические некрозы костей, которые характеризуются выраженным болевым синдромом, нарушением функции суставов, снижением качества жизни и инвалидизацией. Несмотря на то, что эндопротезирование тазобедренного сустава является технически отработанным методом оперативного лечения, пациенты с СКВ по-прежнему составляют группу повышенного риска развития осложнений на всех этапах периоперационного периода.
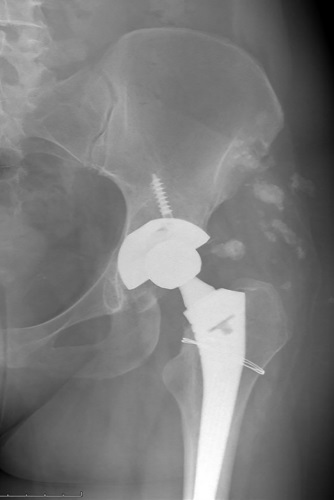
ЦЕЛЬ. Описать влияние СКВ на развитие интраоперационных осложнений при выполнении эндопротезирования тазобедренных суставов.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование включены 133 пациента с диагнозом СКВ, которым за период с 1998 по 2021 гг. выполнено тотальное эндопротезирование тазобедренного сустава. Все оперативные вмешательства выполнялись в травматолого-ортопедическом отделении НИИ ревматологии им. В.А. Насоновой. В группе больных СКВ преобладали женщины, соотношение женщин и мужчинам составило 7,3:1 соответственно. Средний возраст пациентов на момент операции — 36,6±12,6 года.
РЕЗУЛЬТАТЫ. Эндопротезирование тазобедренного сустава всем пациентам (n=133) выполняли стандартно в положении пациента на здоровом боку из переднебокового доступа Хардинга. В 75 случаях (56,3%) была выполнена дополнительная фиксация вертлужного компонента винтами. В 10 случаях был наложен серкляж на проксимальный отдел бедренной кости по причине перелома, возникшего при разработке костномозгового канала. Для уточнения факторов, влияющих на развитие интраоперационного перелома, пациенты с СКВ были разделены на 2 группы: первая группа (n=10) — с интраоперационным переломом, вторая (n=123) — без перелома. Проведена сравнительная характеристика первой и второй групп. Еще одно осложнение на этапе оперативного лечения — повышенный объем кровопотери, потребовавший переливания эритроцитарной взвеси. Таких пациентов было 54 (40,6%). В отношении пациентов с повышенным объемом кровопотери мы сравнили клинико-лабораторные характеристики больных непосредственно перед оперативным лечением с повышенным объемом кровопотери и без такового.
ЗАКЛЮЧЕНИЕ. В исследовании мы провели анализ полученных интраоперационных осложнений. Мы не получили подтверждение влияния суточной и кумулятивной доз ГК, а также степени активности и течения СКВ на риск интраоперационного перелома. Достоверно выше вероятность перелома оказалась у пациентов с исходно сниженной минеральной плотностью костной ткани.
В отношении повышенного объема кровопотери у пациентов с СКВ, достоверно выявлена связь с исходной анемией (сниженным уровнем гемоглобина и гематокрита) в предоперационном периоде (p<0,001).
АКТУАЛЬНОСТЬ. Диабетическая периферическая полинейропатия (ДППН) является распространенным и наиболее ранним хроническим осложнением сахарного диабета (СД). В то же время ДППН может быть ассоциирована с поражением костной ткани и низкотравматичными переломами, особенно при СД 1 типа (СД1). В связи с этим оценка взаимосвязи между нарушением со стороны периферической нервной ткани и параметрами костного обмена актуальна для клинической практики.
ЦЕЛЬ. Оценить параметры костного ремоделирования у больных СД1 с различной степенью выраженности ДППН.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование включены 90 больных СД1 и ДППН в возрасте от 18 до 55 лет на фоне стабильной инсулинотерапии в течение последних 3 месяцев. Проведена оценка уровня гликированного гемоглобина (HbA1c), витамина D (25(OH)D), общего кальция (Са), неорганического фосфора (Р), паратиреоидного гормона (ПТГ), остеокальцина (ОК), С-концевого телопептида коллагена I типа (СTX), фактора роста фибробластов (ФРФ-23) в сыворотке крови. Степень выраженности неврологического дефицита определена по шкале нейропатического дисфункционального счета (NDS), шкале оценки симптомов нейропатии (NSS) и Мичиганскому опроснику для скрининга нейропатии (MNSI). Проведена двухэнергетическая рентгеновская денситометрия (DXA) с определением минеральной плотности костной ткани (МПК) и трабекулярного костного индекса (ТКИ).
РЕЗУЛЬТАТЫ. Независимо от степени выраженности ДППН, больные СД1 были сопоставимы по уровню HbA1c, 25(OH)D. Выявлена прямая корреляционная связь между выраженностью неврологических нарушений и ИМТ (r=0,214; p=0,044), а также стажем СД (r=0,246, p=0,019). Недостаточность и дефицит витамина D диагностированы у 79% обследованных больных СД1, однако уровень 25(ОН)D в сыворотке крови не коррелировал с выраженностью ДППН, а также уровнем HbA1c, длительностью СД и суточной дозой инсулина (p>0,05). Установлена положительная корреляционная связь между уровнем ПТГ и выраженностью неврологических симптомов и отрицательная — с уровнем HbA1c. Больные СД1 и разной степенью выраженности неврологического дефицита не различались по показателям МПК и ТКИ. Z-критерий менее -2,0 SD зарегистрирован всего у шести пациентов (8,8%), а частично деградированная микроархитектоника костной ткани — у 8 пациентов (11,8%). Связи между маркерами костного ремоделирования и параметрами углеводного обмена выявлены не были.
ЗАКЛЮЧЕНИЕ. Таким образом, показатели МПК, ТКИ и маркеры костного ремоделирования у больных СД1 и ДППН не зависели от степени выраженности неврологического дефицита, степени компенсации и длительности СД. Дефицит витамина D характерен для большинства больных СД1, но уровень 25(OH)D не зависит от уровня HbA1c, длительности заболевания и суточной дозы инсулина.
Научный обзор
Наследственные скелетные дисплазии (НСД) относятся к первичным нарушениям роста; встречаются с частотой 1:5000 новорожденных; характеризуются широкой фенотипической гетерогенностью. Диагностика НСД основывается на клинических симптомах (диспропорциональное соотношение сегментов тела), рентгенографических характеристиках минерализации, созревания и морфологии костей, молекулярно-генетических исследованиях. Лечение данной группы пациентов должно быть мультидисциплинарным, поскольку затрагивает не только скелет. Роль детского эндокринолога заключается в том, чтобы оценить потенциал роста этих пациентов и предложить наиболее оптимальное лечение. В обзоре приводятся данные о различных вариантах спондилоэпи(мета)физарной дисплазии (СЭ(M)Д) — большой гетерогенной группе НСД, ассоциированных с низкорослостью. Клинические проявления СЭМД включают низкий рост, нарушение развития позвонков, эпифизов и метафизов длинных трубчатых костей, опережение костного возраста и т.п. Необходима дифференциальная диагностика наиболее распространенных причин низкорослости с генетическими заболевания скелета, которые характеризуются широкой фенотипической гетерогенностью и требуют тщательного обследования. В данном обзоре проводятся анализ и обобщение литературных данных по проблеме спондилоэпифизарной дисплазии как одной из причин идиопатической низкорослости у детей.
Клинический случай
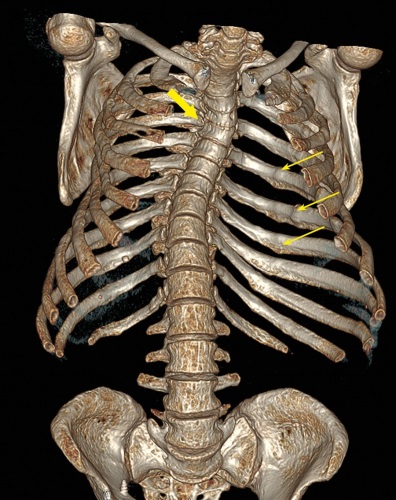
Нейрофиброматоз 1 типа (НФ-1) — аутосомно-доминантное заболевание, обусловленное мутациями в гене NF1, кодирующем белок нейрофибромин. При мутациях в этом гене отсутствует подавление Ras-MAPK пути, что приводит к усилению пролиферации клеток и развитию опухолей. Помимо классических проявлений нейрофиброматоза (кожные проявления, опухоли периферических и черепно-мозговых нервов, сколиоз), у пациентов могут развиваться опухоли эндокринных желез: феохромоцитомы/параганглиомы и нейроэндокринные опухоли. Описаны случаи сочетания НФ-1 с акромегалией, опухолями надпочечников (в том числе с адренокортикальным раком), первичным гиперпаратиреозом (ПГПТ). Кроме того, НФ-1 примечателен развитием в редких случаях гипофосфатемической остеомаляции.
В статье представлено описание клинического случая сочетания у пациентки с НФ-1 с ПГПТ и гипофосфатемии, сохранявшейся после успешного хирургического лечения ПГПТ, и тяжелого поражения скелета с множественными позвоночными и внепозвоночными переломами, что было расценено как сочетание тяжелого остеопороза и гипофосфатемической остеомаляции. На фоне комбинированного лечения деносумабом, терипаратидом и альфакальцидолом достигнута положительная динамика минеральной костной плотности, нормализация уровня фосфора, однако сохраняется отсутствие консолидации перелома диафиза бедренной кости. В литературе имеются лишь единичные описания случаев сочетания НФ-1 одновременно с ПГПТ и гипофосфатемической остеомаляцией.

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
ISSN 2311-0716 (Online)