Перейти к:
Современные подходы к оценке костных нарушений при первичном гиперпаратиреозе: потенциал 3D-моделирования бедренной кости
https://doi.org/10.14341/osteo13200
Аннотация
Первичный гиперпаратиреоз (ПГПТ) является распространенным эндокринным заболеванием, сопровождающимся избыточной секрецией паратиреоидного гормона и нарушением минерального обмена, что приводит к снижению минеральной плотности костной ткани (МПК) и увеличению риска переломов. Для оценки состояния костной системы традиционно используются рентгенография, двухэнергетическая рентгеновская абсорбциометрия (DXA), количественная компьютерная томография (ККТ), периферическая ККТ высокого разрешения и радиочастотная эхографическая мультиспектрометрия (REMS). Однако эти методы имеют определенные ограничения, что обусловливает необходимость поиска новых диагностических подходов. В последние годы активно развивается 3D-моделирование бедренной кости (3D-DXA), позволяющее проводить трехмерный анализ плотности и структуры костной ткани на основе данных DXA. Этот метод демонстрирует высокую точность и корреляцию с ККТ, обеспечивая более детальную оценку изменений в кортикальном и трабекулярном компонентах. Применение 3D-DXA открывает новые перспективы в диагностике и мониторинге костных осложнений при ПГПТ, что может способствовать более точному прогнозированию риска переломов и персонализированному выбору терапевтической тактики.
Для цитирования:
Першина-Милютина А.П., Еремкина А.К., Аредов А.В., Ожималов И.Д., Горбачева А.М., Хайриева А.В., Тарбаева Н.В., Мокрышева Н.Г. Современные подходы к оценке костных нарушений при первичном гиперпаратиреозе: потенциал 3D-моделирования бедренной кости. Остеопороз и остеопатии. 2025;28(2):11-18. https://doi.org/10.14341/osteo13200
For citation:
Pershina-Miliutina A.P., Eremkina A.K., Aredov A.V., Ozhimalov I.D., Gorbacheva A.M., Khairieva A.V., Tarbaeva N.V., Mokrysheva N.G. Modern approaches to assessing bone disorders in primary hyperparathyroidism: the potential of 3D-modeling of the femur. Osteoporosis and Bone Diseases. 2025;28(2):11-18. (In Russ.) https://doi.org/10.14341/osteo13200
Введение
Первичный гиперпаратиреоз (ПГПТ) — частое эндокринное заболевание, характеризующееся избыточной продукцией паратиреоидного гормона (ПТГ) околощитовидными железами (ОЩЖ) и, как правило, повышением уровня кальция крови. К одним из наиболее значимых проявлений ПГПТ относится нарушение костного метаболизма, которое может проявляться как бессимптомным снижением минеральной плотности костной ткани (МПК), так и низкоэнергетическими переломами, деформациями скелета и фиброзно-кистозным остеитом [1]. Костная патология может быть не единственным проявлением заболевания; ПГПТ часто сопровождается другими системными изменениями, такими как нефрокальциноз/нефролитиаз, нарушение фильтрационной и концентрационной функции почек, эрозивно-язвенные поражения желудочно-кишечного тракта, кардиоваскулярные и метаболические заболевания, нервно-психические расстройства [2].
ПТГ играет ключевую роль в поддержании гомеостаза кальция и фосфора. Воздействуя на рецептор PTH-1R, ПТГ стимулирует высвобождение кальция из костного депо путем активации процессов резорбции, усиливает реабсорбцию кальция в проксимальных извитых почечных канальцах, при этом оказывая фосфатурическое действие. В паренхиме почек ПТГ также стимулирует продукцию кальцитриола, который в свою очередь усиливает абсорбцию кальция в кишечнике. В совокупности влияние ПТГ на разные ткани приводит к увеличению концентраций кальция и снижению фосфора в крови [3]. Стойкая гиперсекреция ПТГ вызывает дисбаланс между остеобластной и остеокластной активностью, и как следствие — ускорение костного ремоделирования с преобладанием резорбтивных процессов. При этом патологические изменения затрагивают как кортикальный, так и трабекулярный компонент. Для кортикальной ткани при ПГПТ характерно уменьшение ее толщины, усиление порозности, обуславливающие потерю механических свойств и устойчивости к нагрузкам [4]. В трабекулярной кости избыточная активность остеокластов ассоциирована с уменьшением числа и толщины трабекул, снижением общей костной массы, что также ухудшает механическую прочность. Все эти процессы способствуют прогрессированию остеопороза и увеличению риска переломов [5].
Оценка состояния костной ткани крайне важна для определения стратегии лечения ПГПТ и дальнейшего мониторинга его костных осложнений. Для этого традиционно используются различные методы, включая двухэнергетическую рентгеновскую абсорбциометрию (dual-energy X-ray absorptiometry, DXA), при подозрении на переломы — рентгенографию, компьютерную и магнитно-резонансную томографию (КТ и МРТ соответственно). В научных исследованиях дополнительно анализировались возможности количественной и периферической количественной КТ высокого разрешения, оценки трабекулярного костного индекса (TКИ) и расчета риска остеопоротических переломов при помощи FRAX [4, 5]. В последнее время появляются публикации с применением 3D-моделирования бедренной кости при постменопаузальном остеопорозе, ПГПТ и ряде других заболеваний. Комбинация различных методов позволяет получить более полное представление о состоянии костной системы, способах и темпах ее восстановления.
Целью данной статьи является анализ современных инструментальных методов оценки костной ткани в целом, а также дополнительных возможностей 3D моделирования бедренной кости у пациентов с ПГПТ.
Основные методы оценки патологии костной ткани
Рентгенография — исследование, основанное на пропускании через тело человека рентгеновских лучей, формирующих после прохождения проекции на пленке. С помощью этого метода у пациентов с остеопорозом можно выявить снижение толщины и плотности кортикального слоя и расширение, просветление костномозговой полости. В губчатом веществе эпифизов и в плоских костях наблюдается «крупноячеистая груботрабекулярная» костная структура. Оценка степени “просветления” костной ткани при остеопорозе вследствие снижения ее плотности является очень ненадежным и оператор-зависимым методом, поэтому обычная рентгенография для оценки МПК не используется. Однако рентгенография позволяет визуализировать компрессионные переломы тел грудных и поясничных позвонков (снижение высоты переднего, среднего или заднего участка тела позвонка более чем на 20% относительно других значений). Такие переломы — важный диагностический признак тяжелого остеопороза наряду с низкоэнергетическими переломами бедренной и плечевой костей, таза. В соответствии с действующими клиническими рекомендациями рентгенография грудного и поясничного отделов позвоночника в боковой проекции показана всем пациентам с ПГПТ со снижением в росте на 4 см с молодости и/или на 2 см за последний год [6]. К другим рентгенологическим особенностям при ПГПТ относятся субпериостальная резорбция, кистообразование, гипертрофия надкостницы, диффузная деминерализация. В костях черепа может определяться симптом «перца и соли» — чередование мелких участков разреженной и нормальной плотности. Также характерными являются субпериостальные эрозии костей дистальных и средних фаланг пальцев кистей, обычно более выраженные с лучевой стороны, и кистозные просветления дистальных отделов ключиц [4].
Принцип работы DXA основан на различной способности тканей тела поглощать рентгеновские лучи высоких и низких энергий. Кости, мышечная и жировая ткань обладают разными коэффициентами поглощения, что позволяет системе DXA их разграничивать и строить детализированные изображения. При сканировании производится измерение двух величин: площади исследуемого участка (см2) и минерального содержания кости (МСК, г). Используя данные величины, рассчитывают наиболее значимый клинический параметр — проекционную МПК, которая определяется делением МСК на площадь проекции [7]. Сравнение полученных значений МПК проводится по двум показателям: нормальной пиковой костной массой (T-критерий, показатель сравнивается со средним значением для того возраста, в котором МПК в данном участке скелета достигает максимума), и с возрастной нормой (Z-критерий, показатель сравнивается со средним значением для данного возраста). Результат сравнения представляется в стандартных отклонениях (SD) и в процентах по отношению к соответствующей норме. Всемирная организация здравоохранения (ВОЗ) определяет остеопороз как снижение МПК — по Т-критерию <-2,5 SD у женщин в менопаузе и мужчин старше 50 лет. В остальных ситуациях используют Z-критерий, значение <-2,0 SD соответствует «снижению МПК относительно возрастной нормы», диагноз остеопороз при отсутствии у субъекта малотравматичных переломов в этой группе не устанавливается. На сегодняшний день метод DXA остается золотым стандартом в диагностике и динамическом наблюдении пациентов с остеопорозом и другими состояниями, связанными с потерей МПК. Преимуществами DXA являются относительно невысокая стоимость и низкая лучевая нагрузка по сравнению с другими методами, а также достоверность и воспроизводимость результатов. Однако двумерность получаемого изображения, не позволяющая проанализировать пространственную микроархитектонику кости, является важным ограничением метода [7]. К другим недостаткам DXA можно отнести риск недостоверных результатов у лиц с металлоконструкциями, выраженным аортальным кальцинозом, обызвествлением межпозвоночных дисков, существенным изменением геометрии костных структур (сколиоз) и др. При сравнении DXA с гистоморфометрией чувствительность метода достигает 88,2%, при этом специфичность не превышает 62,5% [8].
У пациентов с ПГПТ снижение МПК в первую очередь происходит в лучевой кости, где преобладает кортикальный компонент, в то время как изменения в областях с преимущественно трабекулярной структурой (например, в поясничном отделе позвоночника) выражены в меньшей степени. Абсолютные значения МПК и Т(Z)-критериев также в наибольшей степени снижены в лучевой кости по сравнению с другими отделами скелета [4]. В исследовании Rubin M.R. и соавт. в течение 15 лет анализировалась динамика МПК у пациентов с бессимптомным ПГПТ. К концу периода наблюдения патологические изменения были зафиксированы в бедренной и лучевой костях, но не в поясничном отделе позвоночника [9]. В то же время у женщин с ПГПТ в постменопаузе — с гипоэстрогенией — может наблюдаться противоположная ситуация, что обусловлено сочетанным генезом остеопороза. С учетом данных особенностей, в отличие от постменопаузального остеопороза, пациентам с ПГПТ измерение МПК необходимо проводить в трех областях: поясничных позвонках, бедренной и лучевой костях [6].
Как уже было сказано выше, DXA не позволяет напрямую оценить эластичность, анизотропию, ориентацию костных пластинок — параметры, значимо влияющие на риск переломов [10]. В связи с этим был разработан метод оценки трабекулярного костного индекса (ТКИ, Trabecular Bone Score — TBS). Оценка костной микроархитектоники в этом случае проводится на основании данных, полученных в ходе стандартной DXA поясничного отдела позвоночника. Не являясь прямым отображением физических измерений трабекулярной микроархитектоники, показатели ТКИ положительно коррелируют со значениями показателей, оцениваемых при количественной КТ и периферической количественной КТ высокого разрешения — фракцией костного объема, плотностью связей, трабекулярным числом и разобщенностью трабекул [11]. Для пациентов с ПГПТ по сравнению с контролем, сопоставимым по полу и возрасту, характерно снижение ТКИ в поясничном отделе позвоночника, несмотря на сохранные показатели МПК по данным DXA [12]. Кроме того, у пациентов с ПГПТ более низкие значения ТКИ были ассоциированы с наличием компрессионных переломов позвоночника, при этом после радикального хирургического лечения отмечалось улучшение данного показателя [13][14].
Количественная компьютерная томография (ККТ) — усовершенствованный протокол КТ с возможностью дополнительной оценки МПК. В основе данного метода лежит сравнение интенсивности сигнала костной ткани и фантомов (образцов с известной плотностью, расположенных в столе томографа) в единицах шкалы Хаунсфилда. Полученные при сравнении данные затем конвертируются в абсолютные показатели МПК. Измеренная при ККТ МПК, в отличие от DXA, имеет объемные характеристики и таким образом более полно отражает реальное состояние кости. При использовании данной методики у пациентов с ПГПТ по сравнению со здоровым контролем отмечалось снижение трабекулярной и кортикальной объемной МПК, уменьшение толщины кортикального слоя и увеличение окружности эндоста в трубчатых костях [15]. Хотя ККТ связана с более высокой лучевой нагрузкой и стоимостью по сравнению с DXA, ее преимуществом является возможность дифференцирования трабекулярного и кортикального компонентов костной ткани с отдельной оценкой объемной МПК, что находит активное применение в исследовательских работах. Также преимуществом ККТ можно назвать возможность ее использования при наличии кальцинатов мягких тканей. Для определения чувствительности и специфичности метода было проведено сопоставление результатов ККТ и DXA. Пациенты с МПК менее -2,5 SD по Т-критерию при DXA были классифицированы как пациенты с остеопорозом, после чего проводилась оценка объема минеральной плотности кортикальной кости (vBMD) по ККТ. Если результат измерения vBMD составлял менее 80 г/см3, то такие случаи также расценивались, как остеопороз. При сопоставлении результатов было показано, что при ККТ было распознано только 76,3% случаев остеопороза, выявленного по DXA (чувствительность) и 77,8% здоровых от общего количества действительно здоровых людей (специфичность) [16]. Недостаточно высокие показатели чувствительности и специфичности не позволяют широко использовать метод ККТ в качестве скринингового инструмента, поэтому в РФ этот метод не валидирован для диагностики остеопороза. Также важно отметить, что Т-критерии ККТ не сопоставимы с таковыми для DXA [17].
Периферическая ККТ высокого разрешения (ПККТВР) позволяет более детально анализировать такие параметры, как толщина, пористость и объем кортикального слоя кости [18]. Даже при мягкой форме ПГПТ при ПККТВР определяются патологические изменения во всем скелете: фиксируется снижение общей объемной плотности в трабекулярном и корковом компонентах, истончение коркового вещества и трабекул, что приводит к их разрозненному и неоднородному распределению. Кроме того, наблюдается уменьшение числа пластинчатых трабекул и преобладание стержнеобразных балок, а также разрушение соединений между ними, что в свою очередь обуславливает потерю осевой ориентации и жесткости трабекулами [19][20].
Радиочастотная эхографическая мультиспектрометрия (REMS) — метод анализа МПК с помощью ультразвукового исследования (УЗИ) костей, основанный на сравнении исходных неотфильтрованных радиочастотных данных (собственно спектра) у пациентов с остеопорозом с эталонными спектрами здоровых людей. При данном исследовании датчик УЗИ устанавливается в проекции интересующих костных структур на несколько десятков секунд, в ходе которых происходит анализ и сравнение спектров [21]. В результате вычисляются два коэффициента — OS (osteoporotic score) и FS (fragility score). OS — параметр, характеризующий процент спектров, классифицированных как остеопоротические. В дальнейшем этот параметр пересчитывается в абсолютное значение МПК, Т- и Z-критерии [22]. Параметр FS рассчитывается при сравнении радиочастотных спектров исследуемого пациента со спектрами людей с низкоэнергетическими переломами (НЭП). Считается, что FS косвенно отражает микроархитектонику костной ткани и является предиктором переломов, не зависимым от МПК [23]. В отличие от предыдущих методов, REMS не использует ионизирующее излучение, что является его преимуществом. Сравнение результатов REMS с DXA показало, что чувствительность и специфичность REMS составляет 90,4 и 95,5% соответственно [24]. Нами была найдена лишь одна публикация по применению REMS у пациентов с ПГПТ. Частота диагностики остеопороза с помощью REMS была ниже, чем при DXA (28,6% vs 64,3%), хотя разница не достигла статистической значимости (p=0,103). Не исключено, что это могло произойти по причине малого объема выборки (n=47) [25].
Среди неинструментальных методов диагностики остеопороза стоит выделить алгоритм расчета 10-летнего риска переломов (бедренной кости и других основных переломов) — FRAX. Расчет риска с помощью FRAX основан на наличии у пациента доказанных факторов риска. Учитываются пол, возраст, вес, рост, наличие переломов в анамнезе, наличие переломов шейки бедренной кости у родителей, курение, прием алкоголя, прием глюкокортикостероидов, наличие ревматоидного артрита или сахарного диабета, вторичный остеопороз. При этом расчет риска перелома может происходит как с использованием абсолютного значения МПК в шейке бедренной кости, так и без. Интерпретация расчетного риска помогает определить дальнейшую тактику ведения пациента — либо дообследование методом DXA (если ранее не проводилось), либо установление диагноза остеопороза и начало соответствующей терапии, либо динамическое наблюдение [26]. FRAX является быстрым, доступным и бесплатным способом достаточно точной оценки риска наличия остеопороза, который широко применяется в амбулаторном звене. Стоит отметить, что пока данная шкала не валидирована для пациентов с ПГПТ и, таким образом, может быть использована лишь в рамках научных исследований.
В ретроспективной работе Khan R. и соавт. сопоставили результаты динамической DXA и риск переломов, определенный с помощью FRAX, у пациентов после паратиреоидэктомии (ПТЭ, n=34) и находящихся на динамическом наблюдении (n=26). В течение трех лет в группе наблюдения определялось увеличение 10-летнего риска перелома бедра (7,5±9,0% против 8,6±9,0; p=0,010) и больших остеопоротических переломов (16,6±10,9% против 18,3±10,8%; p=0,002), в то время как в группе ПТЭ риски обоих типов переломов оставались стабильными (p=0,480 и p=0,430 соответственно). В качестве наиболее сильных предикторов 10-летнего риска перелома шейки бедра (>3%) или больших остеопоротических переломов (>20%) при одно- и многофакторном анализах выступали возраст и исходные значения Т-критерия в бедренной кости [27].
3D-моделирование проксимального отдела бедренной кости (3D-DXA)
3D-моделирование проксимального отдела бедренной кости (3D-DXA) представляет собой инновационный подход, который позволяет проводить трехмерный анализ костной ткани бедренной кости на основе стандартных DXA-сканов. Программное обеспечение использует статистическую модель, позволяющую реконструировать трехмерное изображение бедра и оценить объемные параметры плотности и структуры кости. Для ее построения используется обширная база данных количественной КТ, которая содержит информацию о форме и нормальном распределении минеральной плотности кости в различных анатомических участках. В отличие от 2D-исследования, 3D-визуализация позволяет выявить преимущественное поражение кортикального или трабекулярного компонента костной ткани, а также локальные повреждения, являющиеся потенциальным источником низкоэнергетических переломов в будущем. Анализируются следующие показатели: минеральная плотность поверхности кортикальной кости (cortical surface bone mineral density — cortical sBMD; мг/см2); объем минеральной плотности кортикальной кости (cortical volumetric bone mineral density — cortical vBMD; мг/см3); толщина кортикальной кости (cortical thickness; мм); объем минеральной плотности трабекулярной кости (trabecular volumetric bone mineral density — trabecular vBMD; мг/см3) [7].
Одним из ключевых преимуществ метода является его высокая точность. Валидационные исследования показали, что средняя ошибка при оценке толщины кортикального слоя составляет всего 0,33 мм, а ошибка при измерении объемной плотности кости — 72 мг/см³. Коэффициенты корреляции между результатами 3D-DXA и ККТ-измерениями достигают 0,91–0,95 для различных параметров, что подтверждает надежность технологии. При этом 3D-DXA характеризуется значимо меньшим облучением, чем ККТ, и является экономически более доступным методом [28].
С 2011 по 2024 гг. было опубликовано порядка 60 статей, касающихся применения 3D-DXA. Распределение публикаций по нозологиям представлено на рисунке 1. Ожидаемо, большинство из них было посвящено постменопаузальному остеопорозу.
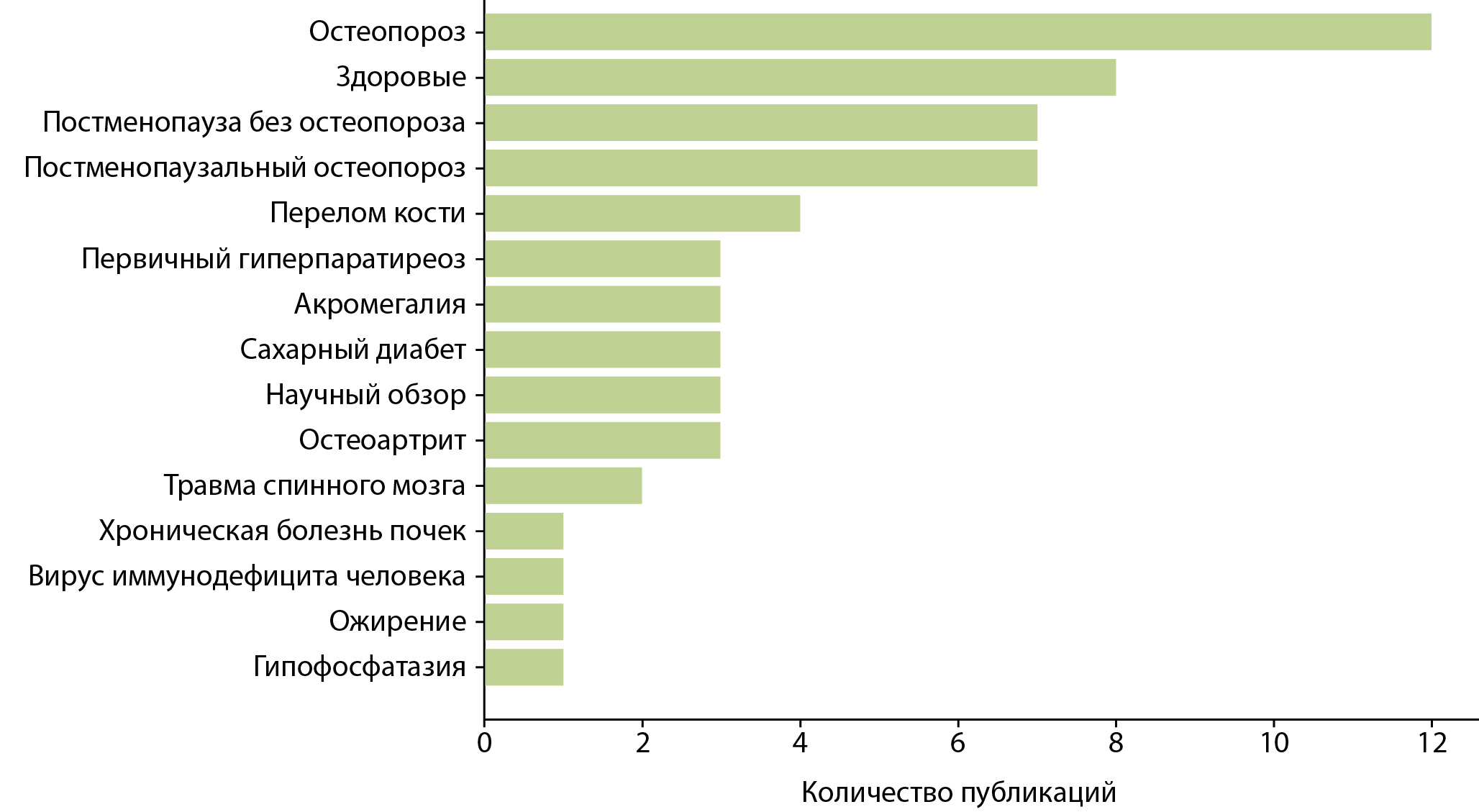
Рисунок 1. Распределение по нозологиям статей с описанием использования 3D-DXA с 2011 по 2024 гг.
Пилотные публикации, которые были направлены на уточнение характера повреждения костной ткани у женщин в постменопаузу, появились в 2017 г. Использование метода 3D-DXA позволило выявить существенное снижение объемных характеристик трабекулярного компонента (на 23,3%) относительно кортикального (на 8,2%) у женщин с постменопаузальным остеопорозом и с переломом шейки бедра в сравнении со здоровым контролем. Различия в кортикальной области были более выражены в медиальной части диафиза, латеральной части большого вертела и верхнелатеральном сегменте шейки бедра [29]. Авторы предположили, что снижение объемных показателей трабекулярного компонента в проксимальном и медиальном отделах бедренной кости может рассматриваться в качестве значимого предиктора остеопоротического перелома.
Также метод 3D-DXA использовался для оценки изолированного влияния антиостеопоретической терапии на отдельные структуры кости. Так, в исследовании Winzenrieth R. и соавт. были проанализированы динамические изменения параметров 3D-DXA на фоне терапии алендронатом, деносумабом и терипаратидом по сравнению с группой контроля. Анализ показателей проводился исходно и спустя 24 месяца. Алендронат показал значимый прирост vBMD трабекулярной кости (+3,8%, р=0,004) и чуть меньший — кортикальной (+1,4%, р=0,003). В группе деносумаба прирост был зафиксирован также по обоим объемным показателям (+7,3%, р<0,001 и +2,0%, р=0,036 для трабекулярного и кортикального отделов соответственно). Эффект терипаратида оказался направленным исключительно на трабекулярную объемную плотность (+5,9%, р=0,030), объем минеральной плотности кортикальной ткани незначительно снижался (-1,1%). Попарное сравнение прироста МПК между разными группами не проводилось. Важно отметить, что сходные результаты ранее уже были получены с помощью метода ККТ [30].
В 2016 г. завершилась третья фаза исследования AСTIVE, в котором оценивалась эффективность терапии абалопаратидом у пациенток с постменопаузальным остеопорозом по сравнению с терипаратидом и группой плацебо. По сравнению с плацебо через 18 месяцев группа абалопаратида продемонстрировала значительный прирост МПК как в поясничном отделе позвоночника, так и в проксимальном отделе бедра. Улучшения при применении абалопаратида были более выражены, чем при терапии терипаратидом, в отношении бедра в целом и его и шейки за весь период наблюдения (р<0,001), в поясничном отделе позвоночника через 6 и 12 месяцев терапии (р<0,001) [31]. В 2021 г. Winzenrieth R. и соавт. провели постанализ данных ACTIVE с помощью 3D-DXA, что позволило получить дополнительные результаты. При сравнении с плацебо увеличение трабекулярной объемной плотности и толщины кортикального слоя наблюдалось при использовании обоих препаратов. В то же время прирост объема минеральной плотности в кортикальном слое был отмечен только при терапии абалопаратидом [32]. Sheth N.P. и соавт. изучали влияние абалопаратида на прирост объемных показателей МПК в четырех зонах Грюна (зоны 1, 2, 6, 7). Эти зоны соответствуют различным анатомическим отделам бедренной кости после проведения тотального эндопротезирования тазобедренного сустава с использованием бесцементной бедренной ножки и характеризуют риски пери-имплантационных переломов, связанных с остеопорозом. Авторы провели «виртуальное эндопротезирование» на 3D-моделях бедренных костей пациентов, принявших участие в исследовании ACTIVE. Главным результатом оказался прирост интегральной объемной МПК во всех исследуемых зонах Грюна за 6 и 18 месяцев терапии, прирост кортикальной и трабекулярной плотности кости фиксировался на 1 и 6 месяцах в зонах Грюна 1 и 7. Это исследование демонстрирует перспективу применения 3D-моделирования в области эндопротезирования тазобедренного сустава, хотя существенным ограничением данной работы остается ее «виртуальность» [33].
Оценка эффективности ромосозумаба при лечении постменопаузального остеопороза проводилась в исследованиях FRAME и ARCH. В первом было показано, что применение ромосозумаба снижает вероятность позвоночных переломов и всех переломов в совокупности, а также приводит к значимому увеличению МПК в поясничном отделе позвоночника и бедренной кости по сравнению с плацебо [34]. В исследовании ARCH сравнивалась эффективность терапии ромосозумабом относительно алендроната. Ромосозумаб был эффективнее алендроната в отношении снижения рисков как позвоночных, так и внепозвоночных переломов, увеличения МПК в поясничном отделе позвоночника и бедренной кости [35]. Дальнейший анализ этих исследований с использованием 3D-DXA был выполнен Lewiecki E.M. и соавт. В сравнении как с плацебо, так и с алендронатом ромосозумаб показал значительное увеличение всех исследуемых объемных характеристик кортикального и трабекулярного компонентов, что подтверждает его эффективность в лечении постменопаузального остеопороза и превосходство в приросте МПК относительно алендроната [36].
Еще одно интересное направление — использование 3D-моделирования в прогнозировании новых переломов. В исследование Iki M. и соавт. были включены 1331 женщина, у которых за 20 лет наблюдений было выявлено 68 случаев переломов бедра. Объемная трабекулярная плотность костной ткани показала более высокую прогностическую точность по сравнению с показателями МПК в шейке бедра, полученными в результате рутинной DXA (площадь под ROC-кривой составила AUC 0,741–0,748 против AUC 0,701). Эти результаты подчеркивают потенциал 3D-моделирования для повышения точности прогнозирования переломов бедра [37].
3D-моделирование в диагностике костных осложнений первичного гиперпаратиреоза
Исследования с применением технологии 3D-DXA при ПГПТ пока немногочисленны. В работе Gracia-Marco L. и соавт., в которую вошло 40 пациентов с ПГПТ и 40 здоровых добровольцев, было показано статистически значимое снижение общей объемной МПК, поверхностной минеральной плотности кортикального ткани, а также ее толщины у пациентов с опухолевым поражением ОЩЖ. При этом объемные показатели трабекулярной и кортикальной плотности значимо не отличались от здорового контроля (р=0,055 и р=0,062 соответственно). Не исключено, что отсутствие статистически значимых различий было прежде всего связано с небольшим объемом выборки. При сравнении пациентов с ПГПТ, которых в соответствии с результатами DXA разбили на подгруппы остеопороза, остеопении и условной возрастной нормы, снижение объемной кортикальной плотности отмечалось именно при МПК <-1,0 SD относительно лиц без костных осложнений. Однако между пациентами с остеопорозом и остеопенией значимых различий выявлено не было [38]. Наихудшие показатели объемной и поверхностной кортикальной МПК наблюдались в области вертела. Это наблюдение согласуется с тем, что переломы вертельной части бедра ассоциированы с более высоким уровнем ПТГ [39].
В другом исследовании Arboiro-Pinel R. и соавт. приняли участие 44 женщины с остеопорозом смешанного генеза (постменопаузальный и ПГПТ) и 48 женщин с постменопаузальным остеопорозом без ПГПТ в качестве контрольной группы. Сравнение объемных параметров МПК при 3D-DXA показало статистически значимое отличие общей и трабекулярной объемной плотности, поверхностной минеральной плотности и толщины кортикальной ткани (р<0,050 для всех), но не кортикальной объемной МПК (p=0,089). При этом пациентки с ПГПТ со случившимися переломами и без них значимо не различались по 3D-DXA параметрам [40].
В следующем исследовании Arboiro-Pinel R. и соавт. группа пациентов с ПГПТ была расширена до 85 человек, 25 из которых были мужчинами. Целью исследования стала оценка динамики объемных параметров МПК после ПТЭ. При 3-летнем наблюдении объемные характеристики МПК в области бедра статистически значимо возросли (р<0,001) за исключением кортикальной объемной плотности (р>0,05). При многофакторном анализе методом линейной регрессии была продемонстрирована сильная ассоциация между процентным приростом трабекулярной объемной МПК за первый год и сывороточной концентрацией бета-кросслапса. Вероятно, нормализация уровня бета-кросслапса после ПТЭ отражает более быстрые темпы прироста МПК в трабекулярном отделе. При этом связь параметров 3D-DXA с предоперационным уровнем ПТГ была либо статистически не значима (для кортикальной и трабекулярной МПК), либо коэффициент регрессии был крайне невелик (r=0,01, ДИ [ 0,00–0,02] для кортикальной поверхностной МПК и r=0,02, ДИ [ 0,00–0,03] для общей объемной МПК) [41].
Нашей исследовательской группой был проведен пилотный проект по оценке костного фенотипа у пациентов с ПГПТ, ассоциированным с наследственным синдромом множественных эндокринных неоплазий 1 типа (МЭН1-ПГПТ) в сравнении со спорадической формой заболевания. Исходно группы были сопоставимы по полу и возрасту, а также параметрам кальций-фосфорного обмена. Анализ 3D-DXA показал преобладание кортикального, а не трабекулярного повреждения при МЭН1-ПГПТ по сравнению со спорадической формой на момент манифестации заболевания. При этом уже через год после операции основные параметры МПК, определенные с помощью DXA и 3D-DXA, стали сопоставимы. Отсутствие различий через год после паратиреоидэктомии в сочетании с исходно более низкой МПК при МЭН1-ПГПТ по сравнению с спорадическим заболеванием может указывать на более быстрое восстановление костной ткани после операции в первой группе [42]. Требуются дальнейшие исследования с большими выборками и сроками наблюдения.
Заключение
Своевременное выявление костных нарушений имеет критическое значение для профилактики НЭП. Уточнение характера повреждения костной ткани при использовании современных методик позволяет разрабатывать персонализированные подходы к лечению, в том числе выбирать оптимальную терапевтическую стратегию. Внедрение трехмерной реконструкции костной ткани на основе данных DXA с использованием технологии 3D-DXA открывает новые горизонты в диагностике и лечении заболеваний, связанных с нарушением минеральной плотности и структуры кости. Данный метод предоставляет клиницистам возможность более детально оценивать кортикальные и трабекулярные структуры, что особенно важно, как для прогноза риска переломов у пациентов с остеопорозом и ПГПТ, так и выбора антиостеопоротического препарата.
Дополнительная информация
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Першина-Милютина А.П. — существенный вклад в дизайн исследования, получение, анализ данных, интерпретацию результатов, написание статьи; Еремкина А.К. — существенный вклад в дизайн исследования, интерпретацию результатов, написание статьи; Аредов А.В. — существенный вклад в анализ данных, интерпретацию результатов, написание статьи; Ожималов И.Д. — написание статьи; Горбачева А.М. — написание статьи; Хайриева А.В. — написание статьи; Тарбаева Н.В. — написание статьи. Мокрышева Н.Г. — одобрение финальной версии рукописи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Bilezikian JP, Khan AA, Silverberg SJ et al. Evaluation and Management of Primary Hyperparathyroidism: Summary Statement and Guidelines from the Fifth International Workshop. J Bone Miner Res. 2022;37(11):2293–314. doi: https://doi.org/10.1002/jbmr.4677
2. Mokrysheva NG. Okoloshchitovidnye zhelezy. Pervichnyj giperparatireoz. Moscow, MIA; 2019. ISBN: 9785907098251 (In Russ.)
3. Ozhimalov ID, Gorbacheva AM, Eremkina AK, et al. Features of the bone metabolism in primary hyperparathyroidism. Russian Journal of Preventive Medicine. 2024;27(9):130‑137 (In Russ.) doi: https://doi.org/10.17116/profmed202427091130
4. Makras P, Anastasilakis AD. Bone disease in primary hyperparathyroidism. Metabolism. 2018;80:57–65. doi: https://doi.org/10.1016/j.metabol.2017.10.003
5. Silva BC, Bilezikian JP. Parathyroid hormone: anabolic and catabolic actions on the skeleton. Curr Opin Pharmacol. 2015;22:41–50. doi: https://doi.org/10.1016/j.coph.2015.03.005
6. Dedov II, Melnichenko GA, Mokrysheva NG, et al. Draft of clinical guidelines for the diagnosis and treatment of primary hyperparathyroidism in adult patients. Endocrine Surgery. 2023;16(4):5-54 (In Russ.) doi: https://doi.org/10.14341/SERG12790
7. Whitmarsh T. Concerns regarding the use of 3D-DXA. Bone. 2021;149:115939. doi: https://doi.org/10.1016/j.bone.2021.115939
8. Humadi A, Alhadithi R, Alkudiari S. Validity of the DEXA diagnosis of involutional osteoporosis in patients with femoral neck fractures. Indian J Orthop. 2010;44(1):73–78. doi: https://doi.org/10.4103/0019-5413.58609
9. Rubin MR, Bilezikian JP, McMahon DJ, et al. The natural history of primary hyperparathyroidism with or without parathyroid surgery after 15 years. J Clin Endocrinol Metab. 2008;93(9):3462–3470. doi: https://doi.org/10.1210/jc.2007-1215
10. Schnitzler CM. Bone quality: a determinant for certain risk factors for bone fragility. Calcif Tissue Int. 1993;53 Suppl 1 (1 Supplement). doi: https://doi.org/10.1007/BF01673398
11. Tsoriev TT, Belaya ZhE, Mel’nichenko GA. Trabecular bone score – a non-invasive analytical method to evaluate bone quality based on routine dual-energy absorptiometry. Perspectives of its use in clinical practice. Almanac of Clinical Medicine. 2016;44(4):462–476 (In Russ.) doi: https://doi.org/10.18786/2072-0505-2016-44-4-23-24
12. Silva BC, Boutroy S, Zhang C, McMahon DJ, Zhou B, Wang J, et al. Trabecular bone score (TBS) – a novel method to evaluate bone microarchitectural texture in patients with primary hyperparathyroidism. J Clin Endocrinol Metab. 2013;98(5):1963–1970. doi: https://doi.org/10.1210/jc.2012-4255
13. Eller-Vainicher C, Filopanti M, Palmieri S, et al. Bone quality, as measured by trabecular bone score, in patients with primary hyperparathyroidism. Eur J Endocrinol. 2013;169(2):155–162. doi: https://doi.org/10.1530/EJE-13-0305
14. Romagnoli E, Cipriani C, Nofroni I, et al. “Trabecular Bone Score” (TBS): an indirect measure of bone micro-architecture in postmenopausal patients with primary hyperparathyroidism. Bone. 2013;53(1):154–159. doi: https://doi.org/10.1016/j.bone.2012.11.041
15. Silverberg SJ, Clarke BL, Peacock M, et al. Current issues in the presentation of asymptomatic primary hyperparathyroidism: proceedings of the Fourth International Workshop. J Clin Endocrinol Metab. 2014;99(10):3580–3594. doi: https://doi.org/10.1210/jc.2014-1415
16. Oh S, Kang WY, Park H, et al. Evaluation of deep learningbased quantitative computed tomography for opportunistic osteoporosis screening. Scientific Reports. 2024;14(1):1–9. doi: https://doi.org/10.1038/s41598-023-45824-7
17. Belaya ZhE, Belova KYu, Biryukova EV, et al. Federal clinical guidelines for diagnosis, treatment and prevention of osteoporosis. Osteoporosis and Bone Diseases. 2021;24(2):4-47 (In Russ.) doi: https://doi.org/10.14341/OSTEO12930
18. Adams JE. Quantitative computed tomography. Eur J Radiol. 2009;71(3):415–24. doi: https://doi.org/10.1016/J.EJRAD.2009.04.074
19. Stein EM, Silva BC, Boutroy S, et al. Primary hyperparathyroidism is associated with abnormal cortical and trabecular microstructure and reduced bone stiffness in postmenopausal women. J Bone Miner Res. 2013;28(5):1029–1040. doi: https://doi.org/10.1002/JBMR.1841
20. Hansen S, Jensen JEB, Rasmussen L, et al. Effects on bone geometry, density, and microarchitecture in the distal radius but not the tibia in women with primary hyperparathyroidism: A case-control study using HR-pQCT. J Bone Miner Res. 2010;25(9):1941–1947. doi: https://doi.org/10.1002/jbmr.98
21. Conversano F, Franchini R, Greco A et al. A novel ultrasound methodology for estimating spine mineral density. Ultrasound Med Biol. 2015;41(1):281–300. doi: https://doi.org/10.1016/j.ultrasmedbio.2014.08.017
22. Messina C, Gitto S, Colombo R, et al. Short-Term Precision and Repeatability of Radiofrequency Echographic Multi Spectrometry (REMS) on Lumbar Spine and Proximal Femur: An In Vivo Study. Journal of Imaging. 2023;9(6):118. doi: https://doi.org/10.3390/jimaging9060118
23. Pisani P, Conversano F, Muratore M, et al. Fragility Score: a REMS-based indicator for the prediction of incident fragility fractures at 5 years. Aging Clin Exp Res. 2023;35(4):763–73. doi: https://doi.org/10.1007/s40520-023-02358-2
24. Cortet B, Dennison E, Diez-Perez A, et al. Radiofrequency Echographic Multi Spectrometry (REMS) for the diagnosis of osteoporosis in a European multicenter clinical context. Bone. 2021;143. doi: https://doi.org/10.1016/j.bone.2020.115786
25. Grassi G, Palmieri S, Cairoli E, et al. Radiofrequency Echographic Multi Spectrometry (REMS) evaluation in patients with primary osteoporosis and primary hyperparathyroidism. 22nd European Congress of Endocrinology. 2020 5-9 September, European Society of Endocrinology Endocrine Abstracts. 2020;80. doi: https://doi.org/10.1530/endoabs.70.AEP134
26. Schini M, Johansson H, Harvey NC et al. An overview of the use of the fracture risk assessment tool (FRAX) in osteoporosis. J Endocrinol Invest. 2024;47(3):501–11. doi: https://doi.org/10.1007/s40618-023-02219-9
27. Khan R, Martin J, Das G. The Impact of Observation Versus Parathyroidectomy on Bone Mineral Density and Fracture Risk Determined by FRAX Tool in Patients With Primary Hyperparathyroidism. J Clin Densitom. 2021;24(4):571–80. doi: https://doi.org/10.1016/j.jocd.2020.12.005
28. Ruiz Wills C, Olivares AL, Tassani S et al. 3D patient-specific finite element models of the proximal femur based on DXA towards the classification of fracture and non-fracture cases. Bone. 2019;121:89–99. doi: https://doi.org/10.1016/j.bone.2019.01.001
29. Humbert L, Bagué A, Di Gregorio S et al. DXA-Based 3D Analysis of the Cortical and Trabecular Bone of Hip Fracture Postmenopausal Women: A Case-Control Study. J Clin Densitom. 2020;23(3):403–410. doi: https://doi.org/10.1016/j.jocd.2018.11.004
30. Winzenrieth R, Humbert L, Di Gregorio S, et al. Effects of osteoporosis drug treatments on cortical and trabecular bone in the femur using DXA-based 3D modeling. Osteoporos Int. 2018;29(10):2323–2333. doi: https://doi.org/10.1007/s00198-018-4624-4
31. Miller PD, Hattersley G, Riis BJ et al. Effect of Abaloparatide vs Placebo on New Vertebral Fractures in Postmenopausal Women With Osteoporosis: A Randomized Clinical Trial. JAMA. 2016;316(7):722–733. doi: https://doi.org/10.1001/jama.2016.11136
32. Winzenrieth R, Ominsky MS, Wang Y, et al. Differential effects of abaloparatide and teriparatide on hip cortical volumetric BMD by DXA-based 3D modeling. Osteoporos Int. 2021;32(3):575–583. doi: https://doi.org/10.1007/s00198-020-05806-1
33. Sheth NP, Russell Smith J, Winzenrieth R et al. Effects of Abaloparatide on Bone Mineral Density in Proximal Femoral Regions Corresponding to Arthroplasty Gruen Zones: A Study of Postmenopausal Women with Osteoporosis. J Bone Joint Surg Am. 2024;106(13):1162–1170. doi: https://doi.org/10.2106/JBJS.23.01334
34. Cosman F, Crittenden DB, Adachi JD et al. Romosozumab Treatment in Postmenopausal Women with Osteoporosis. N Engl J Med. 2016;375(16):1532–1543. doi: https://doi.org/10.1056/NEJMoa1607948
35. Saag KG, Petersen J, Brandi ML et al. Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis. N Engl J Med. 2017;377(15):1417–1427. doi: https://doi.org/10.1056/NEJMoa1708322
36. Lewiecki EM, Betah D, Humbert L et al. 3D-modeling from hip DXA shows improved bone structure with romosozumab followed by denosumab or alendronate. J Bone Miner Res. 2024;39(4):473–483. doi: https://doi.org/10.1093/jbmr/zjae028
37. Iki M, Winzenrieth R, Tamaki J et al. Predictive ability of novel volumetric and geometric indices derived from dual-energy X-ray absorptiometric images of the proximal femur for hip fracture compared with conventional areal bone mineral density: the Japanese Population-based Osteoporosis (JPOS) Cohort Study. Osteoporos Int. 2021;32(11):2289–2299. doi: https://doi.org/10.1007/s00198-021-06013-2
38. Gracia-Marco L, García-Fontana B, Ubago-Guisado E et al. Analysis of Bone Impairment by 3D DXA Hip Measures in Patients With Primary Hyperparathyroidism: A Pilot Study. J Clin Endocrinol Metab. 2020;105(1):175–184. doi: https://doi.org/10.1210/clinem/dgz060
39. Fisher AA, Srikusalanukul W, Davis MW, et al. Clinical profiles and risk factors for outcomes in older patients with cervical and trochanteric hip fracture: similarities and differences. J Trauma Manag Outcomes. 2012;6(1). doi: https://doi.org/10.1186/1752-2897-6-2
40. Arboiro-Pinel R, Mahíllo-Fernández I, Díaz-Curiel M. Bone Analysis Using Trabecular Bone Score and Dual-Energy X-Ray Absorptiometry-Based 3-Dimensional Modeling in Postmenopausal Women With Primary Hyperparathyroidism. Endocr Pract. 2022;28(1):83–89. doi: https://doi.org/10.1016/j.eprac.2021.08.006
41. Arboiro-Pinel R, Mahillo-Fernández I, Díaz-Curiel M. Primary Hyperparathyroidism: Assessment of the Effects of Parathyroidectomy Using Dual X-Ray Absorptiometry, Trabecular Bone Score, and Dual X-Ray Absorptiometry-Based Three-Dimensional Modeling. Endocr Pract. 2024;30(4):340–347. doi: https://doi.org/10.1016/j.eprac.2024.01.004
42. Eremkina AK, Pylina S V., Elfimova AR et al. Analysis of Bone Phenotype Differences in MEN1-Related and Sporadic Primary Hyperparathyroidism Using 3D-DXA. J Clin Med. 2024;13(21). doi: https://doi.org/10.3390/jcm13216382
Об авторах
А. П. Першина-МилютинаРоссия
Першина-Милютина Анастасия Павловна.
117036, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Нет
А. К. Еремкина
Россия
Еремкина Анна Константиновна - к.м.н.
Москва
Конфликт интересов:
Нет
А. В. Аредов
Россия
Аредов Алексей Вячеславович.
Москва
Конфликт интересов:
Нет
И. Д. Ожималов
Россия
Ожималов Илья Дмитриевич.
Москва
Конфликт интересов:
Нет
А. М. Горбачева
Россия
Горбачева Анна Максимовна.
Москва
Конфликт интересов:
Нет
А. В. Хайриева
Россия
Хайриева Ангелина Владимировна.
Москва
Конфликт интересов:
Нет
Н. В. Тарбаева
Россия
Тарбаева Наталья Викторовна - к.м.н.
Москва
Конфликт интересов:
Нет
Н. Г. Мокрышева
Россия
Мокрышева Наталья Георгиевна - д.м.н., профессор.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
Рецензия
Для цитирования:
Першина-Милютина А.П., Еремкина А.К., Аредов А.В., Ожималов И.Д., Горбачева А.М., Хайриева А.В., Тарбаева Н.В., Мокрышева Н.Г. Современные подходы к оценке костных нарушений при первичном гиперпаратиреозе: потенциал 3D-моделирования бедренной кости. Остеопороз и остеопатии. 2025;28(2):11-18. https://doi.org/10.14341/osteo13200
For citation:
Pershina-Miliutina A.P., Eremkina A.K., Aredov A.V., Ozhimalov I.D., Gorbacheva A.M., Khairieva A.V., Tarbaeva N.V., Mokrysheva N.G. Modern approaches to assessing bone disorders in primary hyperparathyroidism: the potential of 3D-modeling of the femur. Osteoporosis and Bone Diseases. 2025;28(2):11-18. (In Russ.) https://doi.org/10.14341/osteo13200

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































