Перейти к:
X-сцепленный остеопороз/несовершенный остеогенез вследствие мутации в гене PLS3: первое описание в России
https://doi.org/10.14341/osteo13201
Аннотация
Остеопороз, манифестирующий в детском возрасте, а также у молодых взрослых, представляет сложности для дифференциальной диагностики. У молодых людей самой частой причиной первичного остеопороза является несовершенный остеогенез (НО). В 2013 г. впервые были описаны 5 семей с X-сцепленным остеопорозом и остеопоротическими переломами, манифестировавшими с детского возраста, у мужчин, у которых были выявлены патогенные варианты в гене PLS3. Ген PLS3 расположен на Х-хромосоме (Xq23) и кодирует белок пластин 3, основная функция которого — связывание и группирование молекул F-актина — основного компонента цитоскелета. В настоящее время в литературе описано около 50 мужчин с этим заболеванием.
В статье представлено описание Х-сцепленного остеопороза/НО у двух братьев, у которых при проведении молекулярно-генетического исследования были выявлены гемизиготные мутации в гене PLS3 ((NM_005032.7) c.836_837dup (p.His280Phefs*43)). У обоих братьев переломы начали происходить с детского возраста (кости предплечий, а у старшего брата также перелом плечевой кости и перелом большого вертела), а в последующем были выявлены множественные компрессионные переломы тел позвонков. Нарушений фосфорно-кальциевого обмена у обоих братьев выявлено не было, при проведении рентгеновской денситометрии выявлено снижение минеральной плотности кости (МПК). У старшего брата начато лечение терипаратидом, младший брат находится на лечении золедроновой кислотой, на этом фоне новых переломов за время наблюдения не отмечено.
Оба сибса получили данный вариант в гене PLS3 от матери, у которой вариант выявлен в гетерозиготном состоянии. У матери пациентов диагностированы первичный гиперпаратиреоз с множественным поражением околощитовидных желез и тяжелый остеопороз с двумя компрессионными переломами тел двух грудных позвонков и выраженным снижением МПК в позвонках. В России случаи X-сцепленного остеопороза/НО вследствие мутаций в гене PLS3 ранее не описаны. Случаи первичного гиперпаратиреоза у пациентов с мутациями в PLS3 не описаны в литературе.
Ключевые слова
Для цитирования:
Мамедова Е.О., Сенюшкина Е.С., Бурякина С.А., Тарасова Е.В., Смирнов К.В., Салахов Р.Р., Хусаинова Р.И., Белая Ж.Е. X-сцепленный остеопороз/несовершенный остеогенез вследствие мутации в гене PLS3: первое описание в России. Остеопороз и остеопатии. 2025;28(2):19-28. https://doi.org/10.14341/osteo13201
For citation:
Mamedova E.O., Senyshkina E.S., Buryakina S.A., Tarasova E.V., Smirnov K.V., Salakhov R.R., Khusainova R.I., Belaya Zh.E. X-linked osteoporosis/osteogenesis imperfecta due to a PLS3 mutation: the first description in Russia. Osteoporosis and Bone Diseases. 2025;28(2):19-28. (In Russ.) https://doi.org/10.14341/osteo13201
АКТУАЛЬНОСТЬ
Остеопороз, манифестирующий в детском возрасте, а также у молодых взрослых, представляет сложности для дифференциальной диагностики. При отсутствии выявления нарушений фосфорно-кальциевого обмена (гипофосфатемический рахит, первичный гиперпаратиреоз, гипофосфатазия и пр.) и при исключении множества вторичных причин (хронический заболевания, прием лекарственных препаратов) диагностируют первичный остеопороз [1]. У молодых людей самой частой причиной первичного остеопороза является несовершенный остеогенез (НО), а при отсутствии выявления генетических причин выставляется диагноз идиопатического ювенильного остеопороза [2]. НО — это фенотипически и генетически гетерогенная группа заболеваний, характеризующаяся хрупкостью костей, деформациями скелета и снижением роста (в некоторых случаях). К другим симптомам, которые варьируют от типа НО, относятся: голубые склеры, снижение слуха, несовершенный дентиногенез, дыхательная недостаточность, дисфункция клапанов сердца, гипермобильность суставов [3, 4]. НО — одна из самых частых скелетных дисплазий, его распространенность составляет 1 на 15 000–20 000 новорожденных. По типу наследования выделяют аутосомно-доминантный, аутосомно-рецессивный, Х-сцепленный рецессивный НО [3]. Этиология НО прямо или опосредованно ассоциирована с коллагеном I типа: в большинстве случаев (80–85%) заболевание обусловлено мутациями в генах, кодирующих альфа-1 и альфа-2 цепи коллагена I типа (COL1A1, COL1A2) (НО I–IV типов). Гораздо реже встречаются другие типы НО (в настоящее время выделяют XXIII типа), большинство из которых наследуются по аутосомно-рецессивному типу и имеют тяжелое течение. Мутации в генах, которые приводят к этим типам НО, приводят к нарушению минерализации кости (IFITM5, SERPINF1, НО V и VI типов), к отсутствию компонентов комплекса пролил-3-гидроксилирования, и, соответственно, к нарушению модификаций коллагена (LEPRE1, CRTAP, PPIB, НО VII, VIII и IX типов), к нарушению процессинга, фолдинга и образования связей между молекулами коллагена (SERPINH1, FKBP10, PLOD2, BMP1, KDELR2 НО X, XI, XIII, XXI типов), к нарушению функции и дифференцировки остеобластов (SP7, TMEM38B, WNT1, CREB3L1, SPARC, MBTPS2, НО XII, XIV, XV, XVI, XVII, XVIII типов), и новые типы НО (TENT5A, MESD, CCDC134, PHLDB1, НО XIX, XX, XXII, XXIII типов) [3][5–8].
В 2013 г. van Dijk и соавт. описали 5 семей с X-сцепленным остеопорозом и остеопоротическими переломами, манифестировавшими с детского возраста, у мужчин, у которых были выявлены патогенные варианты в гене PLS3 [9]. Ген PLS3 расположен на Х-хромосоме (Xq23), состоит из 16 экзонов и кодирует белок пластин 3 [10]. Основная функции пластина 3 — связывание и группирование молекул F-актина (основной компонент цитоскелета), поэтому он участвует в тех же процессах, что и F-актин (движение клетки, адгезия, деление клетки, эндоцитоз и пр.), в том числе в механосенсорной функции остеоцитов [10][11]. Если сразу после открытия случаи вследствие мутаций в PLS3 обозначались в литературе как Х-сцепленный остеопороз, то в последнее время стал фигурировать термин Х-сцепленный НО [12][13], хотя до настоящего времени заболевание не внесено в классификацию НО.
В статье приводится описание Х-сцепленного остеопороза/НО у двух братьев, у которых при проведении молекулярно-генетического исследования были выявлены гемизиготные мутации в гене PLS3. Эта же мутация в гене PLS3 в гетерозиготном состоянии выявлена у матери пациентов. У нее диагностированы первичный гиперпаратиреоз с множественным поражением околощитовидных желез и тяжелый остеопороз. В России подобные случаи ранее не описаны. Случаи первичного гиперпаратиреоза у пациентов с мутациями в PLS3 не описаны в литературе.
ОПИСАНИЕ СЛУЧАЯ
Пациент К.И. впервые госпитализирован в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России в 2023 г. в возрасте 19 лет с жалобами на боли в верхней части спины. Из анамнеза известно, что с 6 до 13 лет происходили переломы костей предплечий с обеих сторон. В 16 лет при падении с высоты собственного роста произошли множественные компрессионные переломы тел позвонков (Th4-Th6, L1). Проводилась консервативная терапия (обезболивание, физиотерапия). По данным рентгеновской денситометрии отмечено выраженное снижение минеральной плотности кости (МПК): в L1–L4 — -4,8 SD, в шейке бедра — -3,9 SD, общий показатель бедра — -4,2 SD по Z-критерию. Назначались препараты кальция и колекальциферола, однако специфическое лечение не проводилось. Также в анамнезе обращало на себя внимание наличие врожденного гипотиреоза, по поводу которого пациент принимал терапию левотироксином натрия. Кроме того, обращал внимание отягощенный семейный анамнез: у старшего брата отмечалось более 10 переломов в анамнезе.
При обследовании: рост — 175 см, вес — 53 кг, ИМТ — 17,3 кг/м2. Костных деформаций нет, склеры обычной окраски, патологии зубов и снижения слуха нет. Данные лабораторного обследования представлены в таблице 1. По рентгеновской денситометрии, выполненной амбулаторно, показатели МПК снижены: в L1–L4 — -4,5 SD, в шейке бедра — -3,3 SD, общий показатель бедра — -3,6 SD по Z-критерию. По МРТ позвоночника — картина консолидированных компрессионных переломов тел Th4–Тh8 позвонков, начальная компрессионная деформация L1. Было принято решение о назначении терапии золедроновой кислотой 5 мг в/в капельно в сочетании с препаратами кальция 500 мг/сут и колекальциферола 2000 МЕ/сут. Через год от начала лечения по данным рентгеновской денситометрии отмечен прирост МПК: в L1–L4 — с -4,5 SD до -4,2, в шейке бедра — с -3,3 до -2,6, общий показатель бедра — с -3,6 до - 2,6 по Z-критерию. По месту жительства проведена повторная инфузия золедроновой кислоты 5 мг. В ходе повторной госпитализации через 1 год в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России по МСКТ позвоночника (рис. 1) выявлены признаки двояковогнутой и клиновидной деформации тел позвонков Th4-8 II степени; Th2, Th11–L2, L4–L4 I степени, однако достоверно сравнить динамику с предыдущими исследованиями не представлялось возможным. Результаты лабораторных исследований представлены в таблице 1. С учетом развития остеопороза в молодом возрасте, наличия отягощенного семейного анамнеза пациенту было проведено полноэкзомное секвенирование (BGI, Китай), по результатам которого выявлена дупликация двух нуклеотидов в гене PLS3, приводящая к сдвигу рамки считывания и образованию преждевременного стоп-кодона — NM_005032.7(PLS3):c.836_837dup, p.His280Phefs*43. По совокупности признаков данный вариант отнесен к вероятно-патогенным.
Пациент К.Н. впервые госпитализирован в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России в 2023 г. в возрасте 37 лет с жалобами на боли в пояснице, боли в лучезапястных и тазобедренных суставах, мышечную слабость. Из анамнеза известно, что с 10-летнего возраста стали происходить переломы костей: пястной кости, плюсневой кости, лучевых костей, хирургической шейки правой плечевой кости, ребер, множественные компрессионные переломы тел позвонков. Последний перелом — большого вертела справа — в возрасте 35 лет. Тогда же проведена однократная инфузия золедроновой кислоты, а через 2 года — однократная инъекция деносумаба 60 мг. Также пациент регулярно принимал препараты кальция 500 мг/сут и колекальциферола 2000 МЕ/сут. По рентгеновской денситометрии, выполненной амбулаторно в 37 лет: в L1–L4 — -2,4 SD, в шейке бедра — -2,3 SD, общий показатель бедра — -2,6 SD по Z-критерию.
При обследовании: рост — 182 см, вес — 82 кг, ИМТ — 24,8 кг/м2. Костных деформаций нет, склеры обычной окраски, патологии зубов и снижения слуха нет. Данные лабораторного обследования представлены в таблице 2. По МСКТ грудного и поясничного отделов позвоночника выявлены множественные компрессионные переломы тел позвонков, начальные дегенеративные изменения грудного и поясничного отделов позвоночника, начальные признаки артроза реберно-позвоночных суставов. S-образный сколиоз, нарушение статики грудного отдела позвоночника. С-образный сколиоз, нарушение статики поясничного отдела позвоночника. Грыжи межпозвонковых дисков в сегментах L4-5, L5-S1. Учитывая наличие множественных переломов, в том числе компрессионных переломов тел позвонков, рекомендовано инициировать анаболическую терапию терипаратидом 20 мкг/сут в сочетании с препаратами кальция и колекальциферола. С учетом наличия остеопороза у младшего брата пациента также проведено полноэкзомное секвенирование и выявлена аналогичная дупликация в гене PLS3 NM_005032.7(PLS3):c.836_837dup, как и у брата. Оба сибса получили данный вариант от матери (рис. 2). Так как ген расположен на Х хромосоме, у матери сибсов изменение выявлено в гетерозиготном состоянии.
При обследовании через 1 год на фоне проводимой терапии у пациента К.Н. по рентгеновской денситометрии в L1–L4 — -2,9 SD, в шейке бедра — -2,5 SD, общий показатель бедра — -2,6 SD по Z-критерию. Трабекулярный костный индекс (TBS) — 1,396 (норма — более 1,310). По МСКТ грудного и поясничного отделов позвоночника (рис. 3): КТ-признаки двояковогнутых и клиновидных переломов тел позвонков Th8-10 (III степень); Th1, Th2, Th4, Th6, Th7, Th11 (II степень); Th3, Th5, L2, L5 (I степень). КТ-картина начальных дегенеративных изменений грудного и поясничного отделов позвоночника, начальных признаков артроза реберно-позвоночных суставов, преимущественно на уровне поясничного отдела. Результаты лабораторного обследования представлены в таблице 2. С учетом отсутствия развития новых переломов, несмотря на отсутствие динамики МПК, принято решение продолжить терапию терипаратидом еще на 1 год.
Мать пациентов — К.Т. — была обследована в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России в 2025 г. в возрасте 59 лет. Из анамнеза известно, что в 2024 г. по месту жительства был выявлен первичный гиперпаратиреоз (повышение паратгормона до 147,2 пг/мл, кальция общего до 2,73 ммоль/л), образование правой нижней околощитовидной железы 20,6х14,5х20 мм (расположено интратиреоидно). Проведено хирургическое лечение по месту жительства, по результатам гистологического исследования — аденома околощитовидной железы, однако ремиссии заболевания достигнуто не было. В детском возрасте дважды были переломы лучевых костей, в возрасте 52 лет — перелом левого голеностопного сустава со смещением. Из сопутствующих заболеваний — нарушение толерантности к глюкозе, артериальная гипертензия 2 ст., первичный гипотиреоз в исходе левосторонней гемиагенезии щитовидной железы.
При обследовании: рост — 162 см, вес — 100 кг, ИМТ=38,1 кг/м2. Костных деформаций нет, склеры обычной окраски, патологии зубов и снижения слуха нет. Данные лабораторного обследования представлены в таблице 3 — по результатам подтверждено отсутствие ремиссии первичного гиперпаратиреоза после оперативного вмешательства. По рентгенографии грудного и поясничного отделов позвоночника выявлены компрессионные переломы тел Th12 (38%), Th10 (23%). По рентгеновской денситометрии в L1–L4 — -3,4 SD по Т-критерию, в шейке бедра — -2,5 SD, общий показатель бедра — -2,0 SD, в 33% лучевой кости — -3,0 SD по Т-критерию. По УЗИ почек конкременты не выявлены. По УЗИ щитовидной и околощитовидных желез: эхографические признаки аденомы левой нижней околощитовидной железы 21х8х9 мм. Пациентке запланировано проведение повторного хирургического лечения первичного гиперпаратиреоза. При анализе результатов секвенирования экзома патогенных вариантов в генах MEN1 и CDC73 не выявлено.
Таблица 1. Результаты лабораторного обследования пациента К.И.
Показатель, единицы измерения / Возраст | 19 лет | 20 лет | Референсный интервал |
Кальций общий, ммоль/л | 2,43 | 2,42 | 2,15–2,55 |
Альбумин, г/л | 47 | 49,2 | 35–50 |
Фосфор, ммоль/л | 1,37 | 1,38 | 0,74–1,52 |
Щелочная фосфатаза, Ед/л | 204 | 45,0 | 40–150 |
Креатинин, мкмоль/л | 70,9 | 77,4 | 63–110 |
Глюкоза, ммоль/л | 4,58 | 4,6 | 3,1–6,1 |
Остеокальцин, нг/мл | 94,89 | 23,0 | 24–70 |
С-концевой телопептид коллагена 1 типа, нг/мл | 1,56 | 0,33 | 0,1–0,85 |
25ОНD, нг/мл | 28,3 | 34,4 | >30 |
ТТГ, мЕд/л | 0,9 | 1,76 | 0,25–3,5 |
Тестостерон, нмоль/л | 19,7 | 27,7 | 11–28,2 |
Пролактин, мЕд/л | 287,7 | 415,8 | 66–436 |
Паратгормон, пг/мл | 33,16 | 28,73 | 15–35 |

Рисунок 1. Пациент К.И. МСКТ грудного и поясничного отделов позвоночника в сагиттальной проекции. Костный режим.
Множественные компрессионные переломы тел позвонков (стрелки).
Таблица 2. Результаты лабораторного обследования пациента К.Н.
Показатель, единицы измерения / Возраст | 37 лет | 38 лет | Референсный интервал |
Кальций общий, ммоль/л | 2,39 | 2,27 | 2,15–2,55 |
Альбумин, г/л | 47,7 | 45,5 | 35–50 |
Фосфор, ммоль/л | 0,87 | 0,84 | 0,74–1,52 |
Щелочная фосфатаза, Ед/л | 51 | 84 | 40–150 |
Креатинин, мкмоль/л | 66,5 | 60,8 | 63–110 |
Глюкоза, ммоль/л | 4,55 | 4,9 | 3,1–6,1 |
Остеокальцин, нг/мл | 8,87 | 20,6 | 24–70 |
С-концевой телопептид коллагена 1 типа, нг/мл | 0,146 | 0,3 | 0,1–0,85 |
25ОНD, нг/мл | 36,4 | 28,3 | >30 |
ТТГ, мЕд/л | 0,515 | 0,676 | 0,25–3,5 |
Тестостерон, нмоль/л | 18,9 | - | 11–28,2 |
Пролактин, мЕд/л | 194,7 | - | 66–436 |
Паратгормон, пг/мл | 45,99 | - | 15–35 |
Кальций в суточной моче, ммоль/сут | 9,54 | 2,5–8,0 |
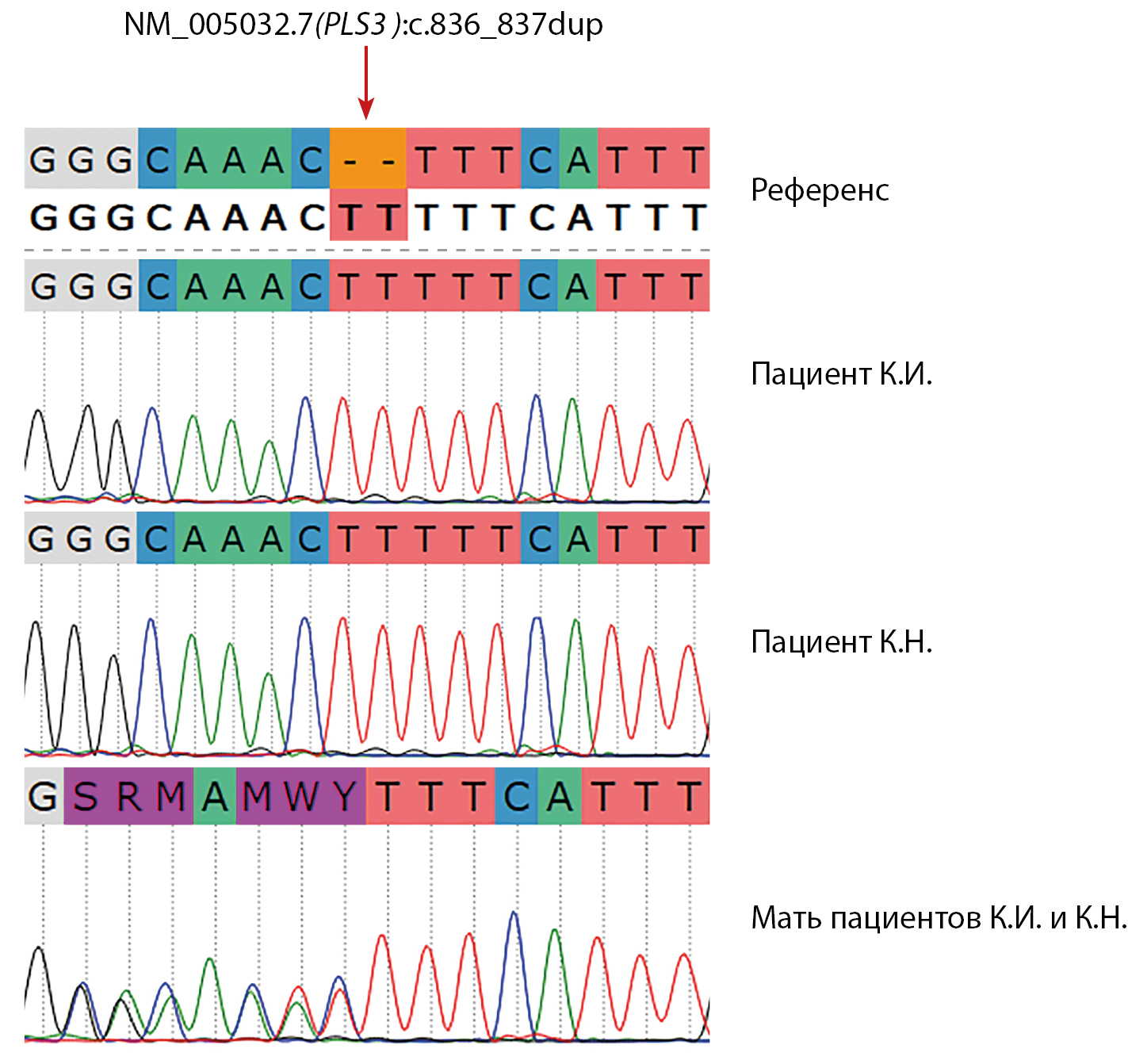
Рисунок 2. Электрофореграмма варианта NM_005032.7(PLS3):c.836_837dup у членов семьи.

Рисунок 3. Пациент К.Н. МСКТ грудного и поясничного отделов позвоночника в сагиттальной проекции. Костный режим.
Множественные компрессионные переломы тел позвонков (стрелки).
Таблица 3. Результаты лабораторного обследования пациентки К.Т.
Показатель, единицы измерения / Возраст | 59 лет | Референсный интервал |
Кальций общий, ммоль/л | 2,65 | 2,15–2,55 |
Альбумин, г/л | 44,3 | 35–50 |
Фосфор, ммоль/л | 0,92 | 0,74–1,52 |
Щелочная фосфатаза, Ед/л | 133 | 40–150 |
Креатинин, мкмоль/л | 64,7 | 63–110 |
Глюкоза, ммоль/л | 5,9 | 3,1–6,1 |
Остеокальцин, нг/мл | 45,1 | 24–70 |
С-концевой телопептид коллагена 1 типа, нг/мл | 1,03 | 0,1–0,85 |
ТТГ, мЕд/л | 4,87 | 0,25–3,5 |
Инсулиноподобный фактор роста 1, нг/мл | 144,6 | 17–238 |
Пролактин, мЕд/л | 238,3 | 69–340 |
Паратгормон, пг/мл | 184,4 | 15–35 |
Кальций в суточной моче, ммоль/сут | 12,65 | 2,5–8,0 |
ОБСУЖДЕНИЕ
Х-сцепленный остеопороз/НО в большинстве случаев проявляется у мужчин. В настоящее время в литературе описано около 50 мужчин с мутациями в гене PLS3. В 2020 г. Hu и соавт. обобщили данные о 44 случаях (все — мужчины) из 25 семей, опубликованных в литературе на тот момент [12]. Авторы выделили следующие характерные клинические особенности: у всех пациентов была снижена МПК, у 40 из 43 пациентов были низкотравматические периферические переломы, а у 33 из 42 — компрессионные переломы тел позвонков. Возраст на момент первого перелома варьировал от 2 до 33 лет. Лицевой дисморфизм наблюдался в 5 случаях. У большинства пациентов был нормальный рост. Внескелетные проявления встречались реже: голубые склеры у 7 человек, гипермобильность суставов у 7 человек, несовершенный дентиногенез у 1 пациента, у 2 пациентов — «утиная» походка. Также у 2 пациентов была неврологическая симптоматика (эпилепсия и расстройство аутистического спектра соответственно) [12]. В последующем в литературе описано еще несколько случаев [13–20], в клинической картине, помимо вышеперечисленного, было отмечено наличие сколиоза как возможного проявления заболевания [14] и открытый артериальный проток [15].
Фенотип у женщин — гетерозиготных носительниц патогенных вариантов в PLS3 варьирует от нормальных показателей МПК до тяжелого остеопороза [10]. Так, Kämpe и соавт. описали случай 10-летней девочки с множественными переломами, в том числе компрессионными переломами тел позвонков, выраженным снижением МПК и мутацией в PLS3 [21]. Также в литературе описано еще несколько случаев тяжелого остеопороза с множественными переломами и компрессионными переломами тел позвонков у женщин — носительниц патогенных вариантов в PLS3 [9][22–25]. Варьирование фенотипа у женщин может объясняться инактивацией X-хромосомы с мутантным аллелем или избежанием инактивации X-хромосомы (escaping X-inactivation) с нормальным аллелем, вследствие чего заболевание у женщин не проявляется или проявляется в мягкой форме [10]. Кроме того, было показано, что у женщин — гетерозиготных носительниц полиморфизма rs140121121 в гене PLS3 была выше частота переломов [9], и авторы выдвинули предположение о связи полиморфизмов в этом гене с остеопорозом в общей популяции. У матери пациентов выявлен тяжелый остеопороз с выраженным снижением МПК в позвоночнике и двумя компрессионными переломами тел грудных позвонков. Генез остеопороза смешанный (постменопауза, гиперпаратиреоз), однако нельзя исключить и роль мутации в PLS3.
Среди описанных мутаций в гене PLS3 не выявлено часто встречающихся (“hot-spot mutations”). В целом, большинство патогенных вариантов в PLS3 — варианты, приводящие к сдвигу рамки считывания, или нонсенс-варианты, приводящие к деградации мРНК, далее следуют варианты, нарушающие механизм сплайсинга, миссенс-варианты и небольшие инсерции/делеции [10][12]. Wu и соавт. провели анализ генотип-фенотип на основании имеющихся литературных данных и пришли к выводу, что корреляции между типом мутации и тяжестью заболевания отсутствуют [14]. Возможно, это связано с тем, что все типы изменений приводят к потере функции пластина 3.
В норме пластин 3 экспрессируется в солидных тканях, а изменения в его экспрессии (как увеличение, так и снижение) задействованы во многих патологических процессах. Отсутствие/снижение экспрессии пластина 3 приводит, как было указано выше, к развитию остеопороза, но механизм этого процесса до конца неясен. Пластин 3 в большом количестве присутствует в дендритах остеоцитов, которые не только выполняют механосенсорную функцию, но и регулируют активность остеобластов и остеокластов [11]. Мутации в PLS3 приводят к нарушению передачи сигналов в остеоцитах, нарушению экспрессии генов в этих клетках и к усилению их апоптоза. В ряде случаев было отмечено снижение минерализации костной ткани и снижение количества остеобластов [10]. Что касается влияния на остеокласты, в исследовании in vitro было показано, что пластин 3 взаимодействует с компонентами NFkB-сигнального пути (основного пути, участвующего в дифференцировке остеокластов), и что остеокласты мышей с нокаутом Pls3 обладают повышенной резорбционной способностью, несмотря на то, что пластин 3 влияет на образование подосом остеокластов [26]. Результаты костной биопсии больных с мутациями PLS3 показали, что у них наблюдается уменьшение количества трабекул, истончение трабекул, уменьшенное количество остеоида и снижение его минерализации, что свидетельствует о снижении костеобразования [23][27].
Помимо остеопороза, пластин 3 задействован в развитии ряда других патологических состояний. Повышенная экспрессия пластина 3 отмечена в хондроцитах пациентов с остеоартритом. Пластин 3 вовлечен в патогенез расслоения грудного отдела аорты. Примечательна роль пластина 3 при нейродегенеративных заболеваниях с повреждением моторных нейронов (спинальная мышечная атрофия, атаксия), где повышение его экспрессии играет протективную роль [10, 11]. Миссенс-варианты в PLS3 были описаны при Х-сцепленных врожденных диафрагмальных грыжах [28]. Пластин 3 также играет роль в метастазировании солидных опухолей, поскольку актиновый цитоскелет непосредственно участвует в миграции и инвазии опухолевых клеток. Так, повышенная экспрессия пластина 3 была выявлена в циркулирующих опухолевых клетках рака толстого кишечника, рака легких, рака молочной железы и рака желудка и являлась плохим прогностическим признаком [10, 11]. Случаев первичного гиперпаратиреоза у пациентов с мутациями в PLS3 ранее описано не было, однако в рамках нашей работы сделать вывод о случайном сочетании или наличии причинно-следственной связи не представляется возможным.
Лечение остеопороза в целом направлено либо на подавление костной резорбции, либо на усиление костеобразования, а специфическое лечение НО не разработано. Данные об эффективности тех или иных препаратов при Х-сцепленном остеопорозе/НО представлены в единичных случаях. В работе van Dijk и соавт. практически все пациенты получали лечение бисфосфонатами (памидронат, алендронат, золедроновая кислота, ризедронат), при этом отмечался прирост МПК, однако данные о развитии новых переломов на фоне лечения не указаны [9]. В исследовании Fahiminiya и соавт. 9-летний мальчик получал лечение алендронатом в течение 6 лет, на этом фоне у него развилось три новых перелома (большеберцовая кость и лучевые кости), но при этом отмечался прирост МПК по денситометрии. Его 5-летний брат получал алендронат в течение 5 лет, на этом фоне развились переломы малоберцовой и лучевой костей, и также отмечался прирост МПК [29]. В исследовании Kämpe и соавт. девочка с остеопорозом и мутацией в PLS3 получала лечение золедроновой кислотой с 6-летнего возраста (доза рассчитывалась по весу) в течение 40 месяцев, при этом отмечался прирост МПК и отсутствие новых переломов [21]. В работе van de Laarschot и соавт. бисфосфонаты применялись у мальчика с 9-летнего возраста в течение 9 лет (памидронат внутривенно в течение 7 лет и ризедронат перорально в течение 2 лет). На этом фоне отмечался прирост МПК, однако происходили множественные переломы (плечевая кость, кости голени), а в 18 лет произошел атипичный перелом бедра как осложнение длительной терапии бисфосфонатами [30]. В исследовании Välimäki изучался ответ на лечение терипаратида в течение 24 месяцев у 3 членов семьи с мутацией в PLS3. У всех пациентов было отмечено повышение маркеров костного ремоделирования, прирост МПК в поясничном отделе позвоночника и бедренной кости, однако отмечалось снижение МПК в дистальном отделе лучевой кости. По данным гистоморфометрического исследования при проведении биопсии крыла подвздошной кости было отмечено увеличение поверхности остеоида, при этом объем остеоида увеличился у одного и уменьшился у 2 больных. Толщина остеоида увеличилась у двух и уменьшилась у одного пациента. По данным микроКТ костных образцов, результаты также противоречивы. Костный объем увеличился в одном случае и уменьшился в двух, количество трабекул увеличилось в одном случае и уменьшилось в двух, толщина трабекул увеличилась в одном случае и уменьшилась в двух (при этом у двух из трех пациентов отмечались дискордантные результаты — увеличение числа трабекул и уменьшение толщины в одном случае, в другом — уменьшение числа трабекул и увеличение их толщины) [25]. В целом, использование терипаратида оправдано у таких больных, поскольку у них снижен костный обмен, однако влияет ли терипаратид на последующий риск переломов, остается неясным. Ни один из существующих видов лечения не воздействует непосредственно на уровень пластина 3. В исследовании Kaifer и соавт. мышам со спинальной мышечной атрофией вводили Pls3 с помощью аденоассоциированных вирусных векторов, что улучшало их выживаемость [31]. Возможно, в будущем будут разработаны новые методы с применением генных и клеточных технологий для лечения этого заболевания [32][33].
Заключение
Х-сцепленный остеопороз/НО вследствие мутаций в гене PLS3 — это крайне редкое заболевание, возникающее в большинстве случаев у мужчин и характеризующееся низкой МПК и низкотравматическими переломами, начинающимися с молодого возраста (как периферическими, так и множественными компрессионными переломами позвонков). Внескелетные проявления, характерные для НО, встречаются гораздо реже. Несмотря на то, что Х-сцепленный характер наследования предполагает наличие заболевания преимущественно у мужчин, в литературе описаны случаи заболевания у женщин. Кроме того, ряд данных указывает на то, что пластин 3 может играть роль в развитии остеопороза как такового. Примечательно, что пластин 3 задействован в развитии некоторых других патологических процессов, в ряде которых он играет протективную роль, а в ряде — является неблагоприятным фактором.
Посредством каких механизмов нарушение функции пластина 3 приводит к остеопорозу, остается неясным. Специфическое лечение НО, в частности этого подтипа, не разработано. Из опубликованных клинических случаев можно сделать вывод, что использование бисфосфонатов сопряжено с повышением МПК по денситометрии, но не предотвращает развитие низкотравматических переломов. Лечение терипаратидом представляется целесообразным, с учетом низкого костного обмена у таких пациентов, однако описанных случаев немного, и данные о влиянии на качество костной ткани противоречивы. В целом, изучение редких заболеваний скелета, проявляющихся остеопорозом, способствует расширению понимания о процессах костного ремоделирования и будет способствовать появлению новых методов лечения в будущем.
Дополнительная информация
Источники финансирования. Работа выполнена в рамках государственного задания «Новые технологии диагностики и дифференциальной диагностики первичного и вторичного остеопороза на фоне эндокринопатий и орфанных заболеваний скелета» № 124020700097-8.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Мамедова Е.О. — лечащий врач пациентов, анализ данных литературы, написание текста статьи; Сенюшкина Е.С. — лечащий врач пациентов К.И. и К.Н.; Бурякина С.А. — проведение рентгенологических методов, написание текста статьи; Тарасова Е.В. — лечащий врач пациентки К.Т.; Смирнов К.В. — проведение молекулярно-генетического исследования; Салахов Р.Р. — биоинформатический анализ данных; Хусаинова Р.И. — биоинформатический анализ данных, редактирование статьи; Белая Ж.Е. — редактирование статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Пациенты добровольно подписали информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Остеопороз и остеопатии».
Список литературы
1. Mäkitie O, Zillikens MC. Early-Onset Osteoporosis. Calcif Tissue Int. 2022;110(5):546-561. doi: https://doi.org/10.1007/s00223-021-00885-6
2. Marrani E, Giani T, Simonini G, Cimaz R. Pediatric Osteoporosis: Diagnosis and Treatment Considerations. Drugs. 2017;77(6):679-695. doi: https://doi.org/10.1007/s40265-017-0715-3
3. Jovanovic M, Guterman-Ram G, Marini JC. Osteogenesis Imperfecta: Mechanisms and Signaling Pathways Connecting Classical and Rare OI Types. Endocr Rev. 2022;43(1):61-90. doi: https://doi.org/10.1210/endrev/bnab017
4. Зарипова А.Р., Надыршина Д.Д., Хусаинова Р.И. Спектр и частоты патогенных изменений у пациентов с несовершенным остеогенезом из Республики Башкортостан. Медицинская генетика. — 2022. — Т.21.— №9. — С.41-44. doi: https://doi.org/10.25557/2073-7998.2022.09.41-44
5. Rossi V, Lee B, Marom R. Osteogenesis imperfecta: advancements in genetics and treatment. Curr Opin Pediatr. 2019;31(6):708-715. doi: https://doi.org/10.1097/MOP.0000000000000813
6. Jovanovic M, Marini JC. Update on the Genetics of Osteogenesis Imperfecta. Calcif Tissue Int. 2024;115(6):891-914. doi: https://doi.org/10.1007/s00223-024-01266-5
7. Меркурьева Е.С. Клинико-генетические характеристики изолированных и синдромальных форм несовершенного остеогенеза: Дис. … канд. мед. наук. — Москва; 2024. Доступно по: https://api.med-gen.ru/site/assets/files/3370/disser_merkureva_e_s_1.pdf. Ссылка активна на 28.03.2025 г.
8. Zaripova AR, Khusainova RI. Modern classification and molecular-genetic aspects of osteogenesis imperfecta. Vavilovskii Zhurnal Genet Selektsii. 2020;24(2):219-227. doi: https://doi.org/10.18699/VJ20.614
9. van Dijk FS, Zillikens MC, Micha D, et al. PLS3 mutations in X-linked osteoporosis with fractures. N Engl J Med. 2013;369(16):1529-1536. doi: https://doi.org/10.1056/NEJMoa1308223
10. Wolff L, Strathmann EA, Müller I, et al. Plastin 3 in health and disease: a matter of balance. Cell Mol Life Sci. 2021;78(13):5275-5301. doi: https://doi.org/10.1007/s00018-021-03843-5
11. Zhong W, Pathak JL, Liang Y, et al. The intricate mechanism of PLS3 in bone homeostasis and disease. Front Endocrinol (Lausanne). 2023;14:1168306. doi: https://doi.org/10.3389/fendo.2023.1168306
12. Hu J, Li LJ, Zheng WB, et al. A novel mutation in PLS3 causes extremely rare X-linked osteogenesis imperfecta. Mol Genet Genomic Med. 2020;8(12):e1525. doi: https://doi.org/10.1002/mgg3.1525
13. Brlek P, Antičević D, Molnar V, et al. X-Linked Osteogenesis Imperfecta Possibly Caused by a Novel Variant in PLS3. Genes (Basel). 2021;12(12):1851. doi: https://doi.org/10.3390/genes12121851
14. Wu Z, Feng Z, Zhu X, et al. Identification of a novel splicing mutation and genotype-phenotype correlations in rare PLS3-related childhood-onset osteoporosis. Orphanet J Rare Dis. 2022;17(1):247. Published 2022 Jun 25. doi: https://doi.org/10.1186/s13023-022-02380-z
15. Qiu C, Li QW, Zhang L, Liu XL. X-linked osteogenesis imperfecta accompanied by patent ductus arteriosus: a case with a novel splice variant in PLS3. World J Pediatr. 2022;18(7):515-519. doi: https://doi.org/10.1007/s12519-022-00539-z
16. Tüysüz B, Elkanova L, Uludağ Alkaya D, et al. Osteogenesis imperfecta in 140 Turkish families: Molecular spectrum and, comparison of long-term clinical outcome of those with COL1A1/A2 and biallelic variants. Bone. 2022;155:116293. doi: https://doi.org/10.1016/j.bone.2021.116293
17. Apperley LJ, Albaba S, Dharmaraj P, Balasubramanian M. PLS3 whole gene deletion as a cause of X-linked osteoporosis: Clinical report with review of published PLS3 literature. Clin Dysmorphol. 2023;32(1):43-47. doi: https://doi.org/10.1097/MCD.0000000000000442
18. Mancini M, Chapurlat R, Isidor B, et al. Early-Onset Osteoporosis: Molecular Analysis in Large Cohort and Focus on the PLS3 Gene. Calcif Tissue Int. 2024;115(5):591-598. doi: https://doi.org/10.1007/s00223-024-01288-z.
19. Aliyeva L, Ongen YD, Eren E, et al. Genotype and Phenotype Correlation of Patients with Osteogenesis Imperfecta. J Mol Diagn. 2024;26(9):754-769. doi: https://doi.org/10.1016/j.jmoldx.2024.05.014
20. Costa A, Martins A, Machado C, et al. PLS3 Mutations in X-Linked Osteoporosis: Clinical and Genetic Features in Five New Families. Calcif Tissue Int. 2024;114(2):157-170. doi: https://doi.org/10.1007/s00223-023-01162-4
21. Kämpe AJ, Costantini A, Mäkitie RE, et al. PLS3 sequencing in childhood-onset primary osteoporosis identifies two novel disease-causing variants. Osteoporos Int. 2017;28(10):3023-3032. doi: https://doi.org/10.1007/s00198-017-4150-9
22. Shao C, Wang YW, He JW, Fu WZ, Wang C, Zhang ZL. Genetic variants in the PLS3 gene are associated with osteoporotic fractures in postmenopausal Chinese women. Acta Pharmacol Sin. 2019;40(9):1212-1218. doi: https://doi.org/10.1038/s41401-019-0219-7
23. Laine CM, Wessman M, Toiviainen-Salo S, et al. A novel splice mutation in PLS3 causes X-linked early onset low-turnover osteoporosis. J Bone Miner Res. 2015;30(3):510-518. doi: https://doi.org/10.1002/jbmr.2355
24. Wang L, Bian X, Cheng G, et al. A novel nonsense variant in PLS3 causes X-linked osteoporosis in a Chinese family. Ann Hum Genet. 2020;84(1):92-96. doi: https://doi.org/10.1111/ahg.12344
25. Välimäki VV, Mäkitie O, Pereira R, et al. Teriparatide Treatment in Patients With WNT1 or PLS3 Mutation-Related Early-Onset Osteoporosis: A Pilot Study. J Clin Endocrinol Metab. 2017;102(2):535-544. doi: https://doi.org/10.1210/jc.2016-2423
26. Neugebauer J, Heilig J, Hosseinibarkooie S, et al. Plastin 3 influences bone homeostasis through regulation of osteoclast activity. Hum Mol Genet. 2018;27(24):4249-4262. doi: https://doi.org/10.1093/hmg/ddy318
27. Wesseling-Perry K, Mäkitie RE, Välimäki VV, et al. Osteocyte Protein Expression Is Altered in Low-Turnover Osteoporosis Caused by Mutations in WNT1 and PLS3. J Clin Endocrinol Metab. 2017;102(7):2340-2348. doi: https://doi.org/10.1210/jc.2017-00099
28. Petit F, Longoni M, Wells J, et al. PLS3 missense variants affecting the actin-binding domains cause X-linked congenital diaphragmatic hernia and body-wall defects. Am J Hum Genet. 2023;110(10):1787-1803. doi: https://doi.org/10.1016/j.ajhg.2023.09.002
29. Fahiminiya S, Majewski J, Al-Jallad H, et al. Osteoporosis caused by mutations in PLS3: clinical and bone tissue characteristics. J Bone Miner Res. 2014;29(8):1805-1814. doi: https://doi.org/10.1002/jbmr.2208
30. van de Laarschot DM, Zillikens MC. Atypical femur fracture in an adolescent boy treated with bisphosphonates for X-linked osteoporosis based on PLS3 mutation. Bone. 2016;91:148-151. doi: https://doi.org/10.1016/j.bone.2016.07.022
31. Kaifer KA, Villalón E, Osman EY, et al. Plastin-3 extends survival and reduces severity in mouse models of spinal muscular atrophy. JCI Insight. 2017;2(5):e89970. doi: https://doi.org/10.1172/jci.insight.89970
32. Yang YS, Xie J, Wang D, et al. Bone-targeting AAV-mediated silencing of Schnurri-3 prevents bone loss in osteoporosis. Nat Commun. 2019;10(1):2958. doi:10.1038/s41467-019-10809-6
33. Schindeler A, Lee LR, O’Donohue AK, Ginn SL, Munns CF. Curative Cell and Gene Therapy for Osteogenesis Imperfecta. J Bone Miner Res. 2022;37(5):826-836. doi: https://doi.org/10.1002/jbmr.4549
Об авторах
Е. О. МамедоваРоссия
Мамедова Елизавета Октаевна - к.м.н.
117292, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Нет
Е. С. Сенюшкина
Россия
Сенюшкина Евгения Семеновна.
117292, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Нет
С. А. Бурякина
Россия
Бурякина Светлана Алексеевна - к.м.н.
117292, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Нет
Е. В. Тарасова
Россия
Тарасова Елена Вячеславовна.
117292, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Нет
К. В. Смирнов
Россия
Смирнов Кирилл Вячеславович.
117292, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Нет
Р. Р. Салахов
Россия
Салахов Рамиль Ринатович - к.м.н.
117292, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Нет
Р. И. Хусаинова
Россия
Хусаинова Рита Игоревна - д.б.н., профессор.
117292, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Нет
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна - д.м.н., профессор.
117292, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Нет
Дополнительные файлы
Рецензия
Для цитирования:
Мамедова Е.О., Сенюшкина Е.С., Бурякина С.А., Тарасова Е.В., Смирнов К.В., Салахов Р.Р., Хусаинова Р.И., Белая Ж.Е. X-сцепленный остеопороз/несовершенный остеогенез вследствие мутации в гене PLS3: первое описание в России. Остеопороз и остеопатии. 2025;28(2):19-28. https://doi.org/10.14341/osteo13201
For citation:
Mamedova E.O., Senyshkina E.S., Buryakina S.A., Tarasova E.V., Smirnov K.V., Salakhov R.R., Khusainova R.I., Belaya Zh.E. X-linked osteoporosis/osteogenesis imperfecta due to a PLS3 mutation: the first description in Russia. Osteoporosis and Bone Diseases. 2025;28(2):19-28. (In Russ.) https://doi.org/10.14341/osteo13201

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































