Перейти к:
Сравнительная оценка влияния ингибиторов натрий-глюкозного ко-транспортера 2 типа и ингибиторов дипептидилпептидазы 4 типа на параметры костного ремоделирования у крыс с экспериментальным сахарным диабетом 2 типа
https://doi.org/10.14341/osteo12926
Аннотация
Обоснование. Сахарный диабет (СД) 2 типа сопровождается повышением риска остеопоротических переломов. Данные о влиянии ингибиторов натрий-глюкозного ко-транспортера 2 типа (иНГЛТ-2) на риск перелома неоднозначны. Одномоментное сравнение эффектов высоко- и низкоселективных иНГЛТ-2 с влиянием других классов на параметры костного метаболизма ранее не проводилось.
Цель. Изучить и сопоставить влияние эмпаглифлозина (ЭМПА), канаглифлозина (КАНА) и ситаглиптина (СИТА) на параметры костного ремоделирования у крыс с СД 2 типа.
Материалы и методы. У самцов крыс Wistar моделировали СД 2 типа при помощи высокожировой диеты и введения стрептозотоцина+никотинамида. Через 4 нед были сформированы группы: «СД» без лечения, а также 8-недельная терапия СИТА 50 мг/кг («СД+СИТА»), КАНА 25 мг/кг («СД+КАНА»), ЭМПА 2 мг/кг («СД+ЭМПА»). В группе «Контроль» не осуществлялось вмешательств. После лечения измеряли концентрацию кальция, фосфора, фактора роста фибробластов-23 (FGF23), остеокальцина (ОС), остеопротегерина (OPG), RANKL, исследовали гистоархитектонику кости.
Результаты. В группе «СД+ЭМПА» уровень кальция (2,79 (2,69; 2,83) ммоль/л) был выше, чем в группе «Контроль» (2,65 (2,53; 3,15)), фосфора (4,71 (4,33; 4,80) ммоль/л) — выше, чем в остальных группах. FGF23 был снижен в группе «СД» (0,24 (0,11; 0,31) пмоль/л), терапия ЭМПА была ассоциирована с более высоким уровнем FGF23 (1,1 (0,62; 1,1). В группе «СД» уровень ОС (10,69 (9,97; 11,03) нг/мл) был ниже, чем в группе «Контроль» (49,1 (47,98; 54,57); применение СИТА и ЭМПА было ассоциировано с более высоким уровнем ОС (19,57 (18,85; 24,44) и 16,00 (15,72; 17,00) соответственно), причем в группе «СД+СИТА» уровень ОС был выше, чем в группе «СД+ЭМПА». Различий в OPG и RANKL между «СД» и «Контроль» не было, при этом OPG был ниже в группах «СД+КАНА» (1,85 (1,19; 1,90) пмоль/л)) и «СД+ЭМПА» (1,26 (0,76; 1,88)), чем в группе «СД+СИТА» (6,28 (3,05; 3,99)). Соотношение RANKL/OPG было наиболее высоким в группах «СД+ЭМПА» и «СД+КАНА», без различий между группами. В группах «СД+ЭМПА» и «СД+КАНА» наблюдалось уменьшение площади костных трабекул в эпифизарной части (56,70 (53,80; 58,05)% и 52,30 (50,50; 54,85)%) по сравнению с группой «Контроль» (62,30 (61,30; 64,20)%). Уровень гликемии был удовлетворительным на фоне всех вариантов терапии.
Заключение. СИТА оказывает нейтральное влияние на параметры костного ремоделирования, терапия ЭМПА и КАНА приводит к повышению костной резорбции. Влияние препаратов на костный метаболизм не связано со степенью контроля гликемии.
Ключевые слова
Для цитирования:
Тимкина Н.В., Симаненкова А.В., Каронова Т.Л., Власов Т.Д., Семенова Н.Ю., Байрамов А.А., Тимофеева В.А., Шимшилашвили А.А., Шляхто Е.В. Сравнительная оценка влияния ингибиторов натрий-глюкозного ко-транспортера 2 типа и ингибиторов дипептидилпептидазы 4 типа на параметры костного ремоделирования у крыс с экспериментальным сахарным диабетом 2 типа. Остеопороз и остеопатии. 2021;24(4):27-38. https://doi.org/10.14341/osteo12926
For citation:
Timkina N.V., Simanenkova A.V., Karonova T.L., Vlasov T.D., Semenova N.Yu., Bairamov А.A., Timofeeva V.A., Shimshilashvili A.A., Shlyakhto E.V. Comparative evaluation of Sodium-glucose co-transporter-2 inhibitors and dipeptidyl peptidase-4 inhibitors influence on bone turnover markers in rats with experimental type 2 diabetes mellitus. Osteoporosis and Bone Diseases. 2021;24(4):27-38. (In Russ.) https://doi.org/10.14341/osteo12926
ОБОСНОВАНИЕ
Сахарный диабет (СД) 2 типа остается одной из ведущих проблем современного здравоохранения. По данным Атласа IDF 2019 г., установлено, что этим заболеванием страдают около 463 млн человек, то есть каждый одиннадцатый в возрасте от 20 до 79 лет [1].
В настоящее время на фармакологическом рынке не только увеличивается количество сахароснижающих лекарственных средств известных классов, но и появляются новые классы. И если ранее предпочтение отдавалось тем препаратам, применение которых способствовало лучшему контролю гликемии, то теперь исключительно глюкоцентрическая парадигма сменилась. Современные алгоритмы лечения пациентов с СД 2 типа [2][3] рекомендуют отдавать предпочтение тем классам препаратов, которые не увеличивают, а, возможно, даже уменьшают сердечно-сосудистые риски и обладают потенциальным нефропротективным действием. Ведущие позиции среди таких классов сахароснижающих лекарственных средств занимают агонисты рецепторов глюкагоноподобного пептида-1 (аГПП-1) и ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ-2), в то время как другие классы, включая ингибиторы дипептидилпептидазы-4 (иДПП-4), по своим свойствам оказывают нейтральный эффект в отношении сердечно-сосудистых и почечных факторов риска [2][3]. При этом современные алгоритмы сахароснижающей терапии, делая фокус на кардиоваскулярной и ренальной безопасности и эффективности, пока не учитывают потенциальное положительное или отрицательное влияние препаратов на костный метаболизм. В то же время хорошо известно, что СД 2 типа является независимым фактором риска изменения архитектоники костной ткани, что может приводить к возникновению низкотравматичных переломов [4]. Последнее приобретает особую актуальность в связи с тем, что большая часть больных СД 2 типа — это люди среднего и пожилого возраста, имеющие повышенный риск остеопоротических переломов в силу возраста и наличия хронических осложнений диабета. Развитие переломов, как известно, помимо резкого ухудшения качества жизни и работоспособности, может явиться и причиной стойкой иммобилизации, инвалидности и даже смерти этих больных [5]. Учитывая тот факт, что больные СД 2 типа могут иметь повышенный риск остеопоротических переломов при нормальной или даже высокой минеральной плотности костной ткани [6], представляется актуальным изучение влияния как самого СД, так и различных вариантов сахароснижающей терапии на суррогатные маркеры метаболизма костной ткани и костного ремоделирования.
Известно, что использование тиазолидиндионов у женщин в менопаузе ассоциировано с увеличением риска остеопоротических переломов [7]. В то же время сведения о потенциальном влиянии новых и передовых классов сахароснижающих лекарственных средств, таких как иНГЛТ-2, на параметры костного метаболизма и риск патологических переломов довольно противоречивы. Имеются единичные данные, свидетельствующие о негативном влиянии низкоселективного канаглифлозина на частоту возникновения переломов [8], в то время как в отношении других представителей этого класса препаратов такие сведения практически отсутствуют. Кроме того, прямое сравнение «костных» эффектов различных представителей класса иНГЛТ-2 между собой, а также с препаратами из других классов в рамках одного исследования ранее не проводилось.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить и сопоставить влияние эмпаглифлозина (ЭМПА), канаглифлозина (КАНА) и ситаглиптина (СИТА) на параметры костного ремоделирования у крыс с СД 2 типа.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование выполнялось на крысах-самцах стока Вистар, полученных из питомника лабораторных животных «Пущино», на базе Центра доклинических и трансляционных исследований Института экспериментальной медицины НМИЦ им. В.А. Алмазова.
Время исследования. Октябрь 2020 — январь 2021 гг.
Изучаемые популяции
Исследование выполнялось на крысах-самцах стока Вистар массой 150–250 г, полученных из питомника лабораторных животных «Пущино».
Крысы содержались не более чем по 5 голов в одной клетке, на неограниченном потреблении корма и воды, при установленном световом режиме 12.00:12.00 ч (свет:темнота). Температура поддерживалась в диапазоне 22–25°С, относительная влажность — 50–70%.
Длительность карантина (акклиматизационного периода) для всех животных составляла 14 дней. Во время карантина проводился ежедневный осмотр животных. Оценивались окраска кожи и видимых слизистых, поведение, характер двигательной активности, изменение характера дыхательных движений, положение хвоста. Взвешивание производилось при поступлении животных и в период карантина — не реже 1 раза в неделю. Животные, имевшие отклонения по весу, общему состоянию или поведению, не были включены в исследование.
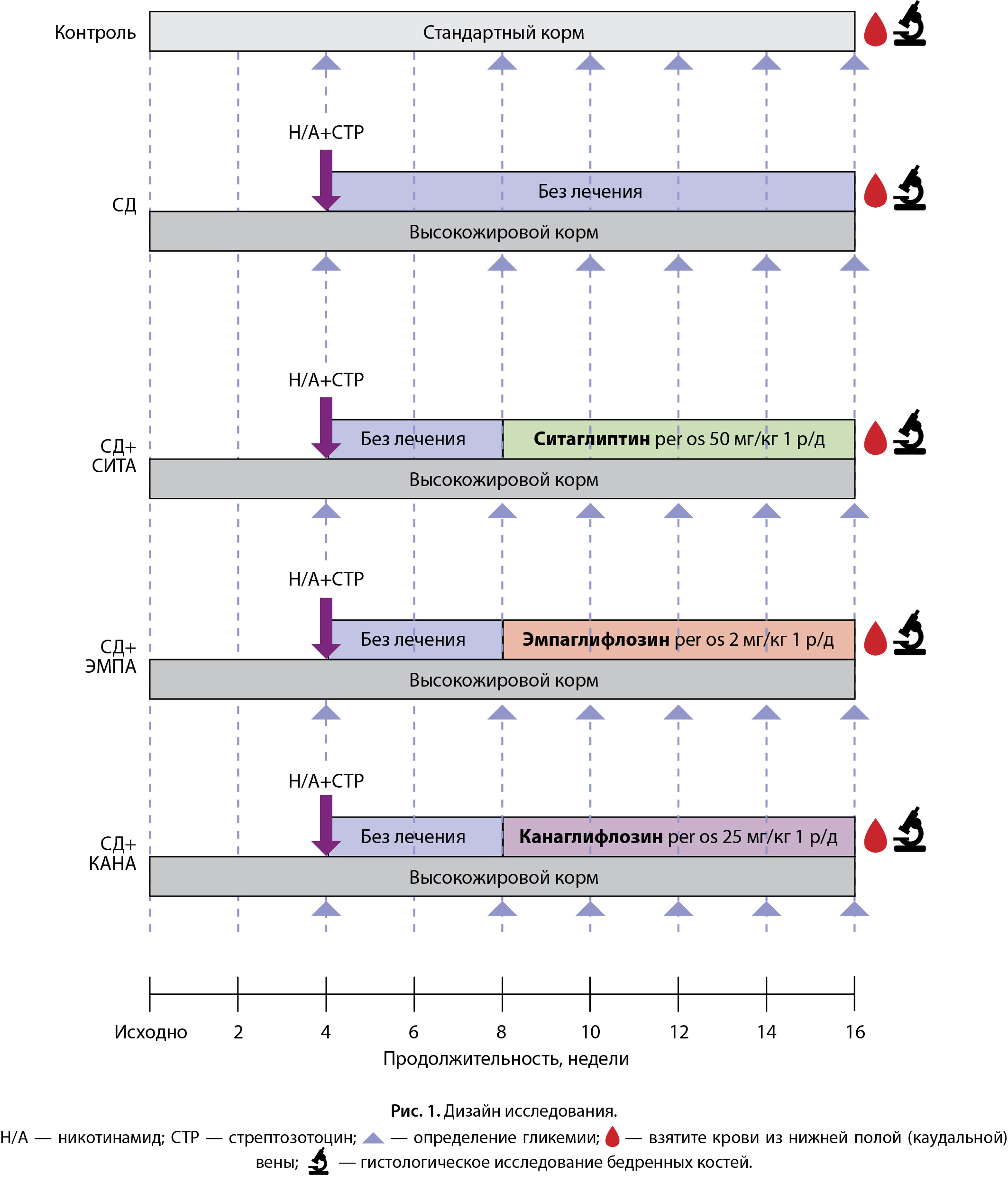
Дизайн исследования
Первоначально крысы общей экспериментальной группы находились на диете с повышенным содержанием жиров («Про Корм», «БиоПро», г. Новосибирск, Россия; обменная энергия 2690 ккал/кг, сырой протеин 20%, сырой жир 22%) в течение 4 нед (и далее на протяжении эксперимента).
Через 4 нед от начала опыта осуществлялось введение раствора никотинамида (Nicotimamide, Sigma-Aldrich, St. Louis, MO, США) 230 мг/кг внутрибрюшинно, через 15 мин — раствора стрептозотоцина (Streptozocin, Sigma-Aldrich, St. Louis, MO, США) 60 мг/кг внутрибрюшинно для индукции СД 2 типа. Данная методика моделирования СД 2 типа при помощи содержания животных на диете, богатой насыщенными жирами, с последующим применением никотинамида и стрептозотоцина применяется в экспериментальных исследованиях и была апробирована нами ранее [9].
На 2 и 3-и сутки после введения никотинамида и стрептозотоцина производилось определение гликемии в хвостовой вене. Нормальными считались значения гликемии от 3,3 до 7,8 ммоль/л, поскольку измерение производилось не натощак. При выявлении в 2 измерениях, выполненных в разные дни, гликемии больше 11,1 ммоль/л диагностировался СД. При обнаружении меньших показателей гликемии хотя бы в одном из измерений выполнялся пероральный глюкозотолерантный тест (ПГТТ). Определение гликемии осуществлялось натощак и через 15, 30 и 60 мин после зондового введения 40% раствора глюкозы 3 г/кг массы тела крысы. При выявлении во время ПГТТ в любой из точек гликемии больше 11,1 ммоль/л диагностировался СД. В случае обнаружения меньших значений гликемии животные исключались из дальнейшего эксперимента.
Через 4 нед после индукции СД при помощи никотинамида и стрептозотоцина производилось повторное определение гликемии, после чего животные были разделены на группы «СД», «СД+СИТА», «СД+ЭМПА», «СД+КАНА».
Наблюдение за крысами и введение исследуемых препаратов продолжалось в течение 8 нед.
Одновременно была создана группа «Контроль» — животные без СД, содержавшиеся на стандартном корме («Koмбикорм ЛБK-120_10 6002», ЗАО «Тосненский комбикормовый завод») в течение 16 нед.
Через 16 нед от начала опыта во всех группах осуществлялся забор крови из нижней полой (каудальной) вены для определения показателей фосфорно-кальциевого обмена и маркеров костного ремоделирования. Анестезию проводили золетилом (тилетамина гидрохлорид 30 мг/кг и золазепама гидрохлорид 30 мг/кг) внутримышечно и ксилазина гидрохлоридом 6 мг/кг внутримышечно. После достижения хирургической стадии наркоза производилась широкая лапаротомия, выделялась нижняя полая (каудальная) вена, осуществлялся забор венозной крови.
После центрифугирования в сыворотке крови исследовались следующие показатели: кальций общий, фосфор неорганический, с последующим вычислением кальций-фосфорного произведения, фактор роста фибробластов-23 (FGF23), остеокальцин (ОС), остеопротегерин (OPG), лиганд активатора рецептора ядерного фактора каппа-бета (RANKL), с вычислением соотношения RANKL/OPG.
После эвтаназии осуществлялся забор биоматериала бедренных костей для гистологического исследования.
Дизайн исследования представлен на рисунке 1.
Описание медицинского вмешательства (для интервенционных исследований)
В ходе исследования были сформированы следующие группы животных.
1.«СД» (n=4) — крысы с экспериментальным СД 2 типа, не получавшие сахароснижающей терапии в течение 12 нед с момента индукции СД.
2.«СД+СИТА» (n=4) — через 4 нед после индукции СД была начата 8-недельная терапия ситаглиптином (Янувия, Merck Sharp & Dohme B.V., Нидерланды) 50 мг/кг per os 1 раз в день.
3.«СД+ЭМПА» (n=4) — через 4 нед после индукции СД была начата 8-недельная терапия эмпаглифлозином (Джардинс, Boehringer Ingelheim, Германия) 2 мг/кг per os 1 раз в день.
4.«СД+КАНА» (n=4) — через 4 нед после индукции СД была начата 8-недельная терапия канаглифлозином (Инвокана, Janssen-Cilag S.p.A, Италия) 25 мг/кг per os 1 раз в день.
5.«Контроль» (n=6) — крысы содержались на стандартном корме в течение 16 нед.
Дозы сахароснижающих препаратов были выбраны на основании имеющихся литературных данных об их применении в эксперименте на крысах [10], а также с помощью перерасчета дозировок, применяемых у человека (в мг/кг), с учетом метаболизма крысы.
Методы
Определение гликемии
Производилась пункция хвостовой вены, после чего содержание глюкозы в полученной капле венозной крови измерялось при помощи прибора определения гликемии и кетонемии StatStrip (Nova Biomedical, США).
В контрольной группе измерение гликемии осуществлялось в конце 4, 8, 10, 12, 14 и 16-й недели эксперимента (постпрандиальные измерения). В группе «СД» определение гликемии производилось через 4 нед эксперимента (на 2 и 3-й день после введения стрептозотоцина), в конце 8, 10, 12, 14 и 16-й недели эксперимента (постпрандиальные измерения). В группах «СД+СИТА», «СД+ЭМПА», «СД+КАНА» оценку гликемии проводили через 4 нед эксперимента (на 2-й и 3-й день после введения стрептозотоцина), в конце 8-й недели, затем каждый 3-й день в течение 8 нед лечения в одно и то же время дня (постпрандиальная гликемия), через 5 ч после лечения.
Определение показателей фосфорно-кальциевого обмена и маркеров костного ремоделирования
Для анализа использовалась сыворотка крови. Концентрации кальция общего и фосфора неорганического определялись при помощи набора реагентов для биохимических анализаторов серии AU (набор реагентов Beckman Coulter, США). Уровень FGF23 (набор для количественного определения фактора роста фибробластов 23, Biomedica, Австрия), ОС (набор реагентов для количественного определения остеокальцина крысы, Immunodiagnostic Systems, Великобритания), OPG (набор реагентов для количественного определения остеопротегерина, Biomedica, Австрия), RANKL (ProcartaPlex Rat RANKL Simplex, Thermo Fisher Scientific, США) оценивались при помощи метода ИФА.
Гистологическое исследование бедренной кости
Образцы бедренных костей фиксировали в 10% забуференном формалине (рН 7,4) в течение 72 ч. Декальцинацию проводили в декальцинирующем растворе с Трилоном Б в течение 14 дней. Готовность образцов определяли с помощью теста с острой иглой — если игла входила в костную ткань без хруста, декальцинацию считали завершенной. Обезвоживание и пропитывание парафином проводили в автоматическом гистопроцессоре Exelsior (Thermo Fischer Scientific, США) в коммерческой среде IsoPREP (Biovitrum, Россия). Затем образцы заливали в парафин HISTOMIX (Biovitrum, Россия), изготавливали срезы толщиной 3 мкм на ротационным микротоме НМ325 (Thermo Fisher Scientific, США). Подготовленные срезы окрашивали гематоксилином-эозином по протоколу производителя (Biovitrum, Россия) и анализировали с использованием микроскопа Nicon Ni-E (Nicon, Япония) с программным обеспечением NIS-Elements для анализа изображений.
Для верификации гистологических изменений оценивали гистоархитектонику ткани. Морфологическая характеристика исследуемых образцов включала следующие параметры: процент костной ткани в диафизе и площадь костных трабекул в эпифизарной части.
Анализ проводился в 5 полях зрения при увеличении ×100. Были рассчитаны среднее значение параметра для каждой выборки, а затем — среднее значение параметра для группы.
Статистический анализ
Статистическая обработка данных производилась при помощи программного пакета IBM SPSS Statistics-22 (IBM, США) и Statistica-10 (Statsoft, США).
Статистический анализ производился при помощи непараметрических методов.
Значимость различий между группами оценивалась с помощью непараметрического критерия Крускала–Уоллиса и Манна–Уитни для независимых выборок с применением непараметрического дисперсионного анализа (апостериорное попарное сравнение групп при помощи критерия Данна) с введением поправки Бонферрони c false discovery rate. Все показатели представлены в виде «медиана (25%; 75%)». Значения Р<0,05 рассматривались как значимые.
Этическая экспертиза
Проведение настоящего исследования одобрено Комиссией по контролю содержания и использования лабораторных животных (IACUC) Национального медицинского исследовательского цента им. В.А. Алмазова, протокол № 19-1П3#V1 от 14.01.2019. Резюме Комиссии по контролю содержания и использования лабораторных животных: «Протокол утвержден».
РЕЗУЛЬТАТЫ
За время акклиматизационного периода у животных не были обнаружены симптомы, которые бы не позволили включить их в дальнейшее исследование. В опыт были включены 28 крыс Вистар массой 221,00 (201,75; 222,25) г. У 4 крыс по результатам повторного определения гликемии в разные дни и последующего проведения ПГТТ не удалось достичь показателей гликемии, позволяющих диагностировать СД, в связи с чем животные были исключены из дальнейшего эксперимента, и в итоговый анализ включены данные по 24 крысам.
При анализе сахароснижающего эффекта различных препаратов нами было установлено, что уровень гликемии в группе «СД» на протяжении всего исследования был выше, чем в группе «Контроль». Применение всех трех изучаемых препаратов привело к снижению гликемии сходной степени выраженности, в то время как исходный гликемический профиль в группах «СИТА», «ЭМПА» и «КАНА» не отличался от такового в контрольной группе (рис. 2).
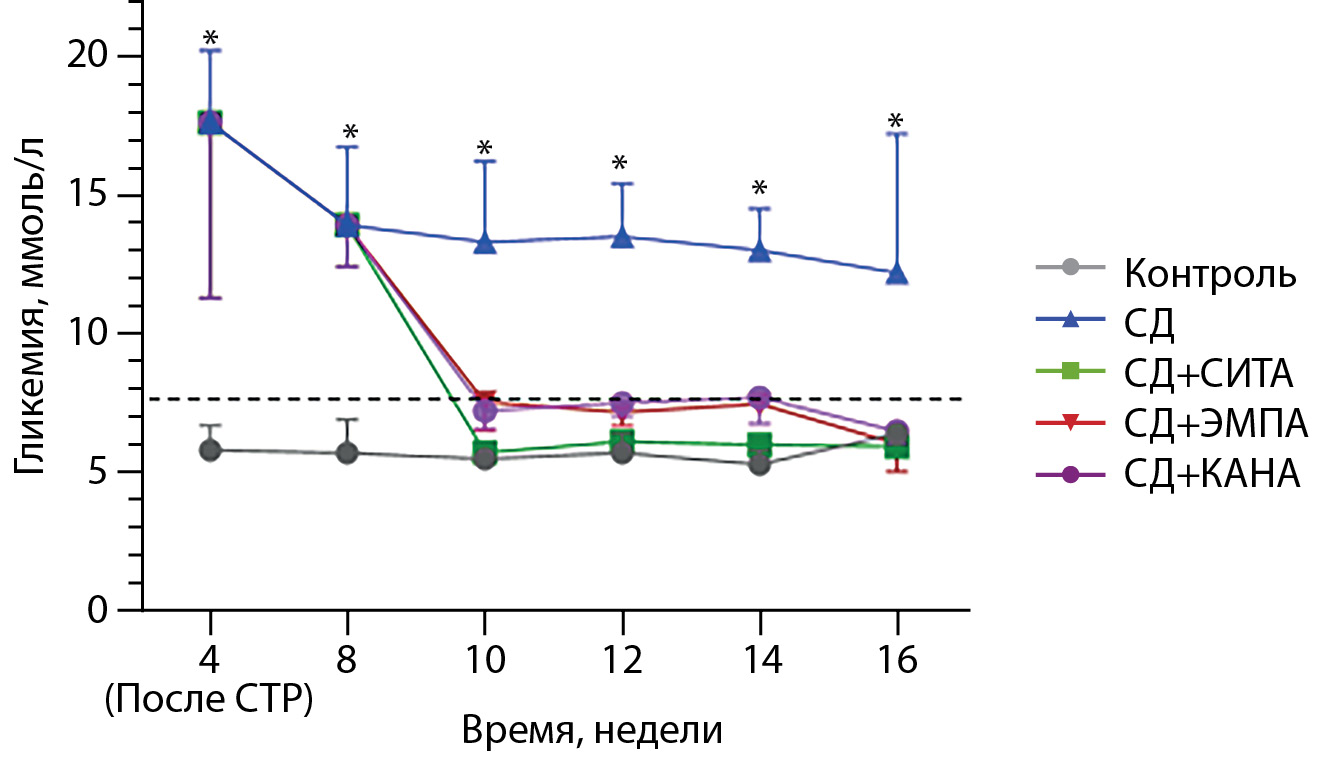
Рис. 2. Динамика постпрандиальных значений гликемии в ходе эксперимента. Результаты представлены в виде медианы (25; 75)%. * — p<0,05 по сравнению с группой «Контроль». СТР — стрептозотоцин; ----- постпрандиальный уровень гликемии в норме.
При анализе показателей фосфорно-кальциевого обмена в зависимости от приема сахароснижающих препаратов было установлено, что в группе «СД+ЭМПА» уровень общего кальция был выше по сравнению с группой контроля (рис. 3А), а фосфора —по сравнению как с контрольной группой, так и с группой «СД» без лечения и с другими вариантами сахароснижающей терапии. При этом в группе «СД» фосфатемия была ниже, чем в группе «Контроль» (рис. 3Б). Наиболее ярко указанные изменения в группах видны при расчете кальций-фосфорного произведения (рис. 3В).
Примечательно, что уровень FGF23 был достоверно ниже как в группе «СД», так и в группах «СД+СИТА» и «СД+КАНА» по сравнению с данным показателем в группе «Контроль». Вместе с этим на фоне терапии ЭМПА концентрация FGF23 была наибольшей по сравнению с данным показателем в других группах животных с СД 2 типа (рис. 3Г).
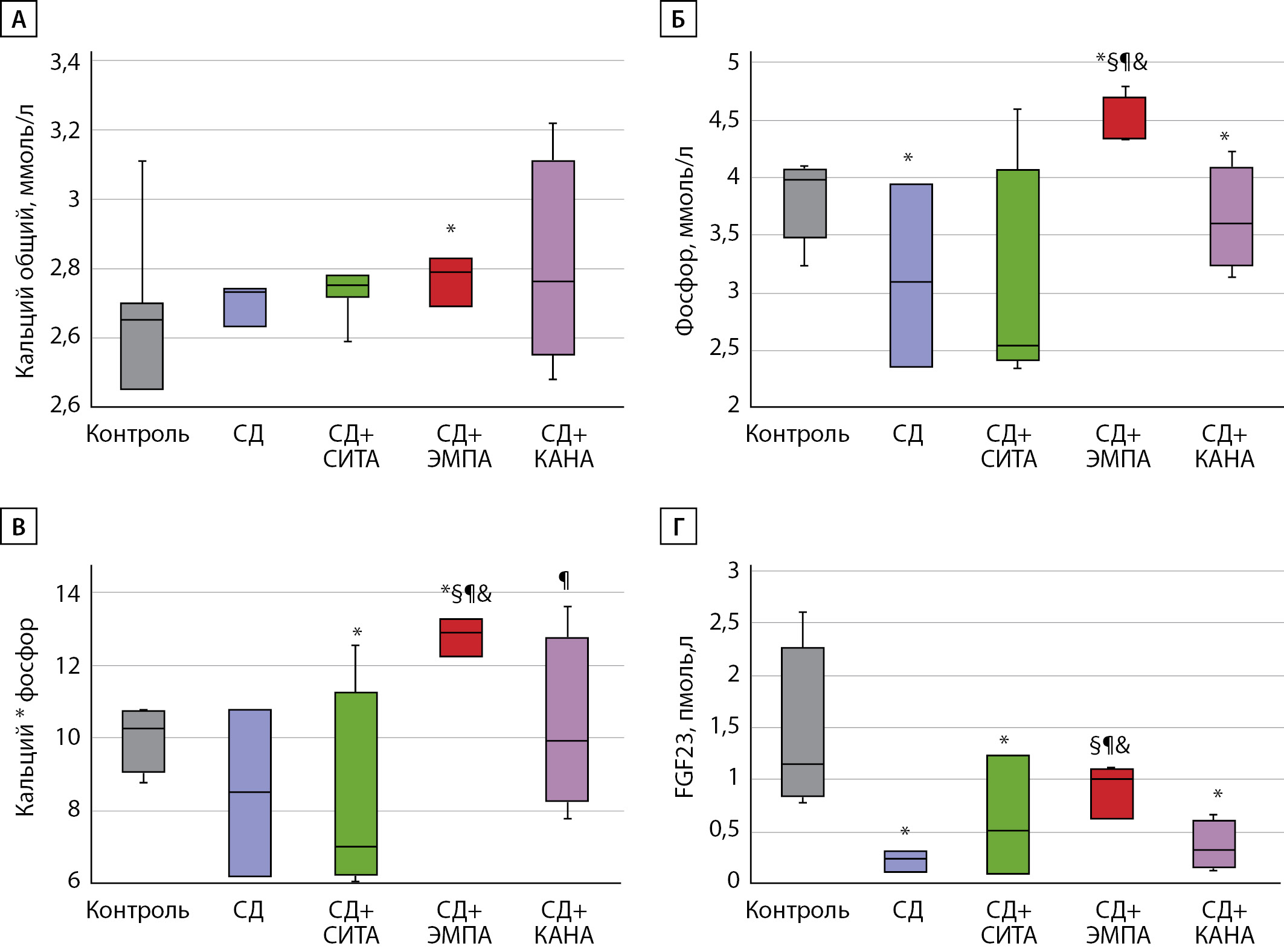
Рис. 3. Показатели фосфорно-кальциевого обмена на фоне различных вариантов сахароснижающей терапии. А — концентрация общего кальция; Б — концентрация фосфора; В — кальций-фосфорное произведение; Г — концентрация фактора роста фибробластов-23. Результаты представлены в виде коробчатых графиков (box-plot), средняя линия соответствует медиане, центральная часть графика — нижнему (25%) и верхнему (75%) квартилям распределения, линии погрешностей — минимальному и максимальному значению в группе. FGF23 — фактор роста фибробластов-23. * — р<0,05 по сравнению с группой «Контроль»; § — р<0,05 по сравнению с группой «СД»; ¶ — р<0,05 по сравнению с группой «СД+СИТА», & — р<0,05 между группами «СД+ЭМПА» и «СД+КАНА».
Нами было выявлено, что концентрация ОС достоверно ниже в группе «СД» по сравнению с контрольной группой, что совпадает с имеющимися литературными данными о снижении скорости костного обмена при СД 2 типа. На фоне терапии как СИТА, так и ЭМПА концентрации ОС была несколько выше, однако уровень последнего не достигал значений, характерных для здоровых животных без СД. В то же время уровень ОС в группе «СД+СИТА» был достоверно выше, чем в группе «СД+ЭМПА». Применение КАНА не было ассоциировано с повышением уровня исследуемого маркера, ОС был достоверно ниже в этой группе, чем в группах «СД+ЭМПА» и «СД+СИТА», и не отличался от такового в группе «СД» без лечения (рис. 4А).
Уровни OPG и RANKL достоверно не различались в группах «Контроль» и «СД», однако имели тенденцию к повышению у животных с СД 2 типа. Все варианты исследуемой сахароснижающей терапии были ассоциированы с более низким уровнем OPG по сравнению с группой «Контроль». В то же время нами выявлены более низкие показатели ОPG на фоне применения обоих представителей иНГЛТ-2, чем на фоне применения СИТА, достоверных различий между группами «СД+ЭМПА» и «СД+КАНА» получено не было (рис. 4Б). Уровень RANKL в группах «СД+СИТА» и «СД+ЭМПА» не отличался от такового у здоровых животных. При этом на фоне применения КАНА значение RANKL было выше как по сравнению с другими вариантами терапии, так и по сравнению с группой «СД» без лечения и здоровым контролем (рис. 4В). Примечательно, что соотношение RANKL/OPG достоверно не различалось между группами «Контроль» и «СД», а максимальное значение соотношения RANKL/OPG было выявлено в группах животных, получавших оба иНГЛТ-2, «СД+ЭМПА» и «СД+КАНА», при этом различий между данными группами выявлено не было (рис. 4Г). Полученные результаты могут указывать на активацию резорбции костной ткани при приеме любых иНГЛТ-2.
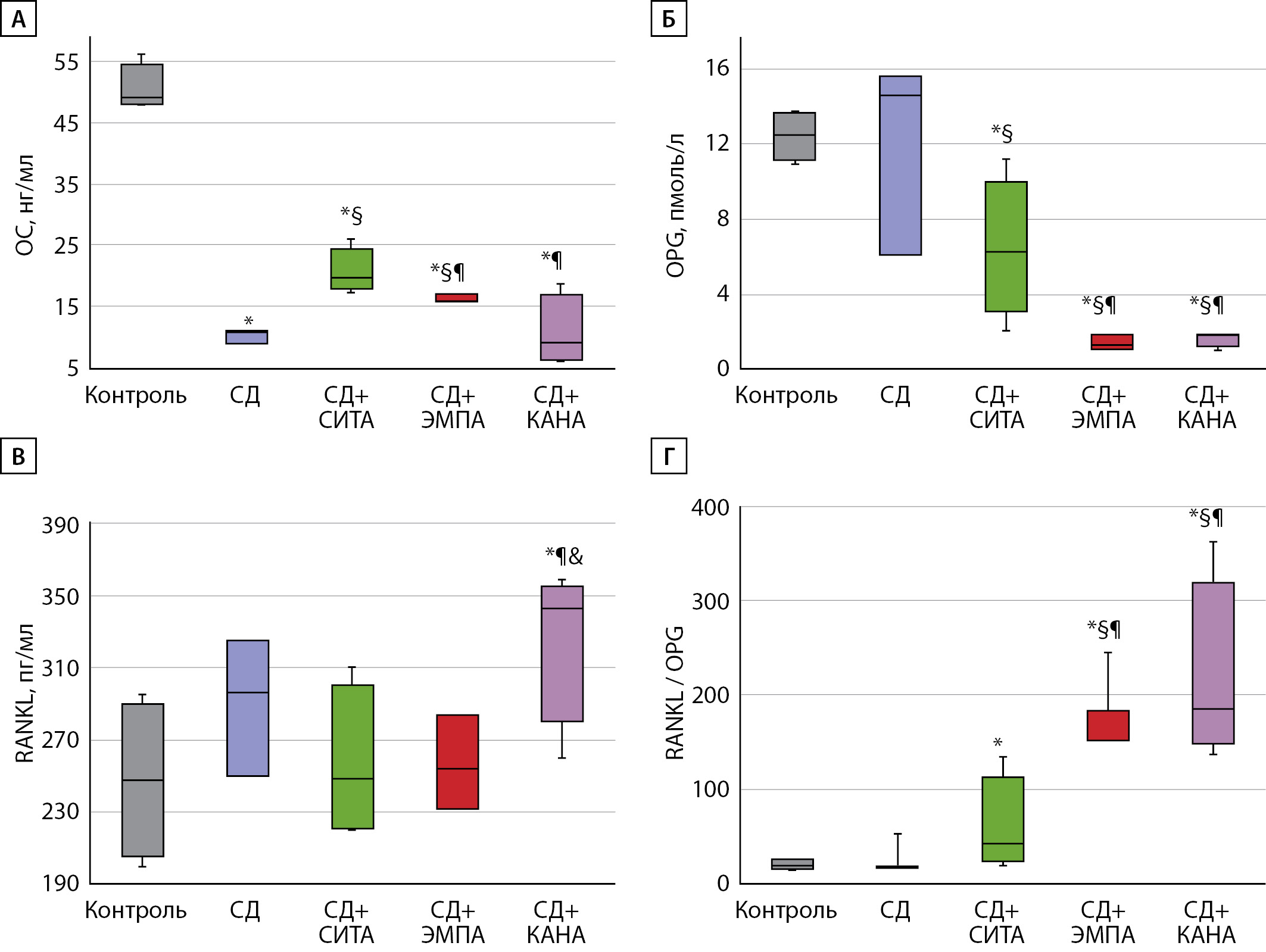
Рис. 4. Параметры костного обмена на фоне различных вариантов сахароснижающей терапии. А — концентрация остеокальцина; Б — концентрация остеопротегерина; В — концентрация лиганда активатора рецептора ядерного фактора каппа-бета (RANKL); Г — соотношение RANKL/остеопротегерин. Результаты представлены в виде коробчатых графиков (box-plot), средняя линия соответствует медиане, центральная часть графика — нижнему (25%) и верхнему (75%) квартилям распределения, линии погрешностей — минимальному и максимальному значению в группе. ОС — остеокальцин; OPG — остеопротегерин; RANKL — лиганд активатора рецептора ядерного фактора каппа-бета. * — р<0,05 по сравнению с группой «Контроль»; § — р<0,05 по сравнению с группой «СД»; ¶ — р<0,05 по сравнению с группой «СД+СИТА»; & — р<0,05 между группами «СД+ЭМПА» и «СД+КАНА».
Результаты гистологического исследования бедренных костей показали, что у здоровых животных контрольной группы компактная костная ткань диафиза не имеет особенностей, остеоциты равномерно распределены, каналы остеонов овальной формы. Костная ткань в диафизе занимает 42,40 (41,35; 43,75)% толщины диафиза, в эпифизарной части 62,30 (61,30; 64,20)% площади поля зрения занято костными трабекулами (табл. 1), которые формируют крупнопетлистую сеть. Костные трабекулы с ровными краями, выраженными линиями цементации (рис. 5А).
В группе «СД» без лечения не было выявлено значимых различий в гистоархитектонике костной ткани зоны диафиза по сравнению с группой «Контроль», однако отмечалось меньшее количество остеоцитов и визуально определялись расширенные каналы остеонов в диафизарной части. В то же время у животных с СД площадь костных трабекул в эпифизарной зоне была меньше таковой в группе здорового контроля (табл. 1), а также отмечалась потеря связи части трабекул друг с другом (рис. 5Б), что может свидетельствовать о первичных перестройках костной ткани при СД 2 типа.
В группе «СД+СИТА» отмечено незначительное сокращение площади костных трабекул в эпифизарной части до 57,80 (56,20; 61,25)% (р>0,05 по сравнению с «Контролем») (рис. 5В, табл. 1). В группах «СД+ЭМПА» (рис. 5Г) и «СД+КАНА» (рис. 5Д) уменьшение площади костных трабекул в эпифизарной части было более выражено: 56,70 (53,80; 58,05)% и 52,30 (50,50; 54,85)% соответственно (р<0,05) как по сравнению с группой «Контроль», так и по сравнению с группой «СД» без лечения (табл. 1). Указанные изменения были более выражены в группе «СД+КАНА», чем «СД+ЭМПА» (статистическая тенденция, р=0,056). Также у животных, получавших оба иНГЛТ-2, отмечались изрезанность поверхности костных трабекул, неровные края. Эти гистологические особенности могут свидетельствовать об усилении процессов, связанных с костной резорбцией.
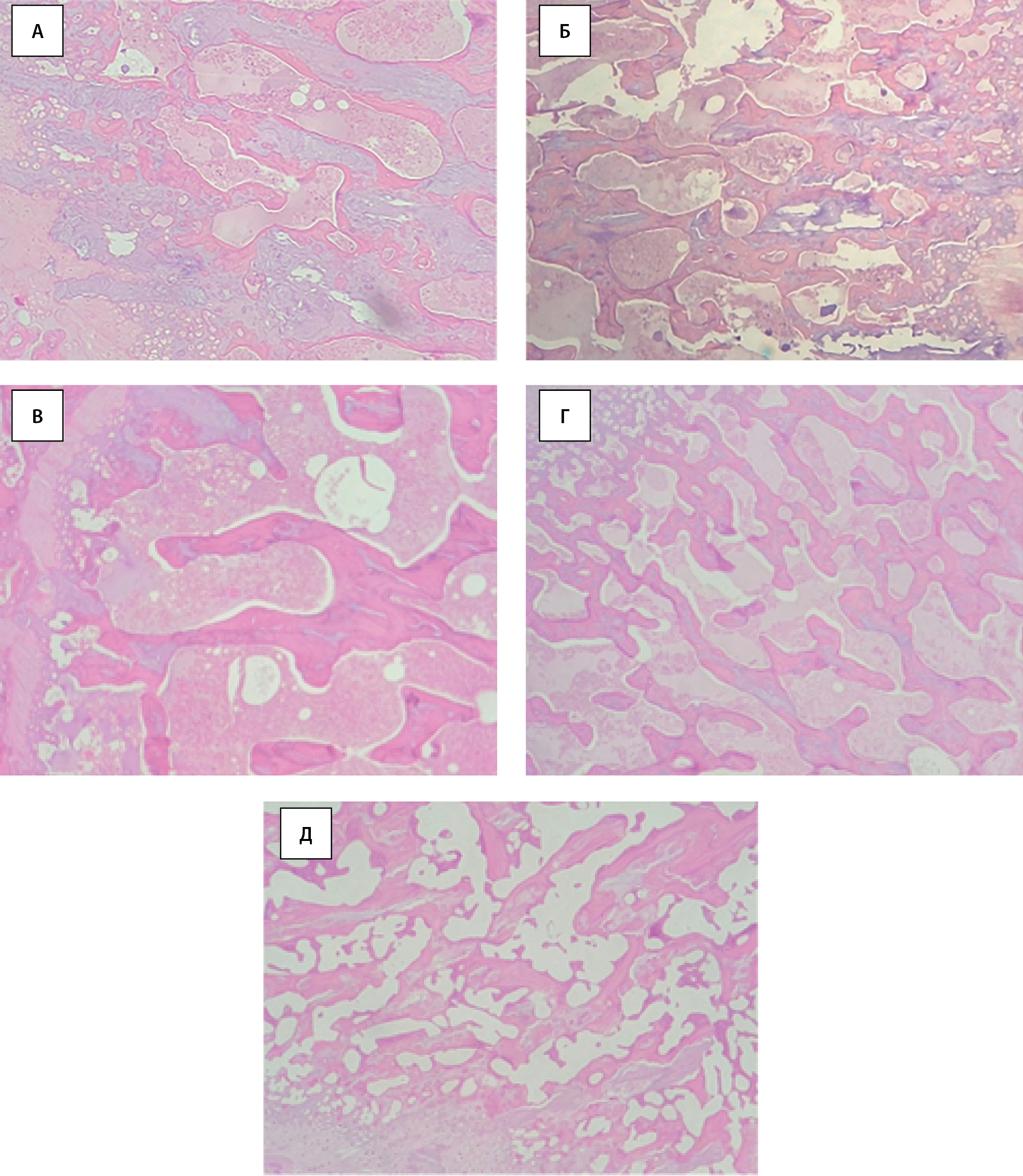
Рис. 5. Эпифизарная область кости с костными балками. А — «Контроль»; Б — «СД»; В — «СД+СИТА»; Г — «СД+ЭМПА»; Д — «СД+КАНА». Окраска гематоксилином-эозином, х100.
Таблица 1. Процент и площадь костной ткани в диафизарной и эпифизарной части бедренной кости в исследуемых группах
Параметр | Контроль | СД | СД+СИТА | СД+ЭМПА | СД+КАНА |
Костная ткань в диафизе, % толщины диафиза | 42,40 (41,35; 43,75) | 41,20 (38,70; 44,95) | 43,50 (38,70; 47,15) | 42,30 (40,85; 43,90) | 39,50 (37,85; 42,90) |
Площадь костных трабекул в эпифизарной части, % | 62,30 (61,30; 64,20) | 60,30 (59,85; 61,15) * | 57,80 (56,20; 61,25) | 56,70 (53,80; 58,05) *§ | 52,30 (50,50; 54,85) *§¶ |
Нежелательные явления
В ходе исследования нежелательных явлений выявлено не было.
ОБСУЖДЕНИЕ
Сопоставление с другими публикациями
Оценивая показали концентрации кальция и фосфора в крови у животных СД 2 типа, получавших различную сахароснижающую терапию, мы обнаружили, что ЭМПА оказывает наиболее выраженное влияние на параметры фосфорно-кальциевого обмена. Так, в группе «СД+ЭМПА» концентрация фосфора и показатель кальций-фосфорного произведения были выше, чем в других группах. Это сочеталось с более высоким уровнем FGF23, концентрация которого, однако, не превышала таковую у здоровых животных. Вероятно, индуцированная ЭМПА гиперфосфатемия стимулирует выработку FGF23 остеоцитами. Эта гипотеза активно изучается в настоящее время, однако не нашла убедительного подтверждения в нашем исследовании в ходе проведения корреляционного анализа — мы не выявили достоверной положительной корреляционной связи между уровнем фосфора крови и FGF23, но отметили статистическую тенденцию при проведении математического анализа. Предположительно, отсутствие достоверных различий в полученных результатах может быть связано с малым объемом выборки. Имеются данные о том, что при СД 2 типа нарушается процесс фосфат-индуцированной стимуляции выработки паратгормона (ПТГ) и активации остеоцитов, приводящей в физиологических условиях к повышению концентрации FGF23. Так, в исследовании K. Yoda было показано, что у пациентов с СД 2 типа наблюдается снижение амплитуды реакции FGF23 и ПТГ на пероральное введение 2 г препарата фосфора, а также быстрое возвращение концентрации указанных маркеров к исходному уровню, что отражает нарушение физиологического ответа FGF23 и ПТГ на транзиторную гиперфосфатемию [11]. Возможно, именно такой характер нарушений лежит в основе низкого уровня FGF23 у животных с СД в нашей работе.
Результаты проведенного исследования позволяют предположить, что результирующее влияние иДПП-4, а именно СИТА, на костный метаболизм может считаться нейтральным или даже позитивным, так как в группе «СД+СИТА» значение ОС было максимальным, а уровень RANKL — минимальным среди трех групп животных, получавших различные сахароснижающие препараты. Литературные сведения о влиянии терапии иДПП-4 на параметры костного метаболизма и риск остеопоротических переломов остаются весьма противоречивыми. Так, метаанализ 28 рандомизированных клинических исследований показал, что применение иДПП-4 снижает риск низкотравматичных переломов, по сравнению с плацебо или другими видами терапии у пациентов с СД [12]. Также исследование, проведенное в Германии, продемонстрировало, что добавление иДПП-4 к терапии метформином у пациентов с СД 2 типа позволяет снизить риск переломов по сравнению с монотерапией метформином [13]. В то же время другой метаанализ не выявил достоверных различий в риске низкотравматичных переломов между пациентами, получавшими иДПП-4, и контрольной группой [14]. Исследование, проведенное в Китае у 744 женщин в постменопаузе, показало, что наименьшая МПК в поясничном отделе позвоночника и проксимальном отделе бедренной кости ассоциирована с наибольшей активностью дипептидилпептидазы-4 (ДПП-4) [15]. Аналогично было показано, что у женщин с ожирением имеется отрицательная корреляционная связь между активностью ДПП-4 и МПК в позвоночнике, что дает основание полагать, что ингибирование указанного фермента может оказать положительное влияние на МПК [16]. Однако, учитывая тот факт, что СД 2 типа может не сопровождаться достоверным снижением МПК на ранних этапах своего развития, проведенная нами оценка динамики суррогатных маркеров костного метаболизма на фоне применения иДПП-4 — СИТА, показавшая в целом нейтральное влияние препарата на костный метаболизм, представляется актуальной.
Анализ уровня костных маркеров при использовании препаратов из группы иНГЛТ-2 продемонстрировал, что применение как высокоселективного иНГЛТ-2 ЭМПА, так и низкоселективного иНГЛТ-2 КАНА вызывает усиление процессов костной резорбции. Мы не можем исключить, что негативное влияние КАНА на костный метаболизм при СД может быть несколько более выражено, так как именно животные, получавшие КАНА, имели самый низкий уровень ОС, что отражает максимальное ингибирование костеобразования, и наивысшие показатели RANKL, свидетельствующие об активации костной резорбции. В то же время мы наблюдали одинаково высокое соотношение RANKL/OPG, которое принято считать наиболее достоверным интегральным показателем активности костной резорбции, в группах «СД+ЭМПА» и «СД+КАНА». Кроме того, на фоне применения обоих иНГЛТ-2, вне зависимости от степени селективности их действия, мы обнаружили уменьшение площади костных трабекул в эпифизарной части, а также признаки усиления костной резорбции, такие как изрезанность поверхности костных трабекул и неровные края.
Говоря о степени селективности действия иНГЛТ-2, необходимо вспомнить, что натрий-глюкозный ко-транспортер (НГЛТ) 2 типа экспрессируется преимущественно в проксимальных канальцах почек и ответственен за реабсорбцию около 90% глюкозы, попадающей в первичную мочу. НГЛТ 1 типа представлен в слизистой оболочке тонкой кишки, в проксимальных канальцах почек, в миокарде, в капиллярах различных органов и тканей, а также некоторых регионах головного мозга: в гиппокампе, гипоталамусе, клетках Пуркинье мозжечка, коре головного мозга [17]. Примечательно, что ни НГЛТ 1 типа, ни НГЛТ 2 типа не обнаружены на поверхности остеобластов или остеокластов, в связи с чем, наиболее вероятно, препараты класса иНГЛТ оказывают свой эффект в отношении костной ткани опосредованно, через влияние на фосфорно-кальциевый обмен, на массу тела. Именно в связи с отсутствием непосредственной точки приложения для действия как высоко-, так и низкоселективных в отношении НГЛТ 2 типа препаратов на уровне костной ткани представляется столь актуальным сравнительное изучение их остеотропных эффектов. Выявленное нами отсутствие достоверных различий в выраженности активации костной резорбции под действием ЭМПА и КАНА, на наш взгляд, может быть объяснено отсутствием прямого воздействия препаратов на костную ткань.
В то же время литературные данные об эффекте различных представителей иНГЛТ-2 в отношении костного метаболизма и риска низкотравматичных переломов остаются противоречивыми. Метаанализ 38 рандомизированных контролируемых исследований показал, что применение иНГЛТ-2 не ассоциировано с повышением риска перелома. По сравнению с плацебо КАНА и ЭМПА не увеличивали частоту остеопоротических переломов [18]. Аналогично этому метаанализ 20 исследований, включивший данные 8286 пациентов, показал, что применение указанного класса не увеличивает риск переломов у больных СД 2 типа [19]. В то же время в исследовании CANVAS частота переломов верхних и нижних конечностей была достоверно больше в группе КАНА по сравнению с группой плацебо, независимо от дозы препарата, что также может быть обусловлено большей частотой падений среди этих пациентов. Однако после проведения дополнительного анализа, в который были включены только низкотравматичные переломы, статистической достоверности в исследуемом параметре не выявлялось. Необходимо отметить, что в других проведенных исследованиях частота переломов при применении КАНА не отличалась от таковой в контрольной группе [8]. Результаты единичных исследований демонстрируют, что КАНА и эртуглифлозин усиливают резорбцию кости, в то время как дапаглифлозин и ЭМПА не оказывают достоверного влияния на показатели костного ремоделирования [20, 21].
Таким образом, по результатам анализа литературных данных достоверно утверждать, что для всех иНГЛТ-2 характерны нарушение костного ремоделирования и увеличение риска переломов, до сегодняшнего дня нельзя. Вместе с тем в прямом сравнительном исследовании нами выявлено негативное влияние как высокоселективного ЭМПА, так и низкоселективного КАНА на параметры костной резорбции, что позволяет предполагать, что данное действие все же целесообразно рассматривать как класс-эффект. Проведенное исследование является первым в своем роде, позволившим одномоментно изучить и сопоставить влияние двух представителей класса иНГЛТ-2 с разной степенью селективности в отношении НГЛТ-2 на параметры костного ремоделирования.
Важно отметить, что применение всех трех исследуемых нами препаратов привело к нормализации гликемического профиля, причем значимых различий между сахароснижающим эффектом СИТА, ЭМПА и КАНА выявлено не было. Следовательно, мы можем предположить, что выявленное нами усиление костной резорбции под действием ЭМПА и КАНА является самостоятельным эффектом данных препаратов, не связанным с параметрами углеводного обмена.
Таким образом, проведенное нами исследование позволило впервые непосредственно и одномоментно сравнить влияние высоко- и низкоселективных иНГЛТ-2 и иДПП-4 на параметры костного ремоделирования и сопоставить полученные данные с единичными литературными сведениями о негативном влиянии отдельных представителей класса иНГЛТ-2 на показатели костеобразования и костной резорбции.
Мы можем заключить, что влияние СИТА на костный метаболизм является нейтральным или даже незначительно положительным, что характеризуется более высоким уровнем остеокальцина в группе животных с СД, получавших СИТА. Терапия ЭМПА и КАНА, напротив, приводит к активации костной резорбции. Вероятно, негативное влияние иНГЛТ-2 на костный метаболизм является класс-эффектом, в то же время степень его выраженности может быть различна у различных представителей класса.
Клиническая значимость результатов и направления дальнейших исследований
Проведенное нами исследование создает предпосылки для дальнейшего изучения влияния имеющихся классов сахароснижающих препаратов на кость, что может способствовать оптимизации алгоритмов назначения сахароснижающей терапии с учетом рисков остеопоротических переломов у больного СД 2 типа или наличием низкотравматичных переломов в анамнезе, тем самым представляя собой основу развития персонализированной медицины.
Ограничения исследования
Ограничения проведенного нами исследования могут быть связаны с малым объемом выборок, а также с возможным наличием гендерных различий в степени выраженности изменений костного метаболизма. Данный эксперимент, в соответствии с классическими принципами, был выполнен на самцах, в то время как нельзя исключить, что у самок крыс, особенно при моделировании менопаузы, изменения костного метаболизма могут быть отличны от таковых у самцов, и требуется проведение дальнейших исследований, в том числе одномоментного сопоставления изучаемых параметров у самцов и самок.
ЗАКЛЮЧЕНИЕ
Таким образом, проведенное нами исследование позволило впервые одномоментно сопоставить влияние высоко- и низкоселективных иНГЛТ-2 между собой и с эффектами иДПП-4 на параметры костного ремоделирования.
Результирующее влияние СИТА на костное ремоделирование является нейтральным. Терапия как КАНА, так и ЭМПА ассоциирована с усилением костной резорбции. Несмотря на более высокие значения RANKL на фоне терапии КАНА, влияние обоих исследованных иНГЛТ-2 на костную резорбцию сходно по степени выраженности, что проявляется в высоком соотношении RANKL/OPG, а также в обнаруженных изменениях гистоархитектоники костной ткани. Указанные эффекты исследуемых препаратов являются самостоятельными, не обусловленными выраженностью сахароснижающего эффекта.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование проводилось в НМИЦ им. В.А. Алмазова в рамках государственного задания Министерства здравоохранения Российской Федерации № 121031100296-0 «Персонифицированный подход в выборе сахароснижающей терапии у больных СД 2 типа, основанный на нейропротективных и остеопротективных свойствах препаратов».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Тимкина Н.В. — получение и анализ данных, написание статьи; Симаненкова А.В. — получение и анализ данных, интерпретация результатов, написание статьи; Каронова Т.Л. — создание концепции и дизайна исследования, внесение в рукопись правки; Власов Т.Д. — создание концепции и дизайна исследования, внесение в рукопись правки; Семенова Н.Ю. — получение и анализ данных, написание статьи; Байрамов А.А. — получение данных, написание статьи; Тимофеева В.А. — получение данных, написание статьи; Шимшилашвили А.А. — получение данных, написание статьи; Шляхто Е.В. — создание концепции и дизайна исследования, внесение в рукопись правки.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. IDF Diabetes Atlas [Internet]. Available from: https://diabetesatlas.org/data/en/world/.
2. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом: Клинические рекомендации (Вып. 9) // Сахарный диабет. — 2019. — Т. 22. — №S1. — С. 1-144. doi: https://doi.org/10.14341/DM221S1
3. Davies MJ, D’Alessio DA, Fradkin J, et al. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2018;61(12):2461-2498. doi: https://doi.org/10.1007/s00125-018-4729-5
4. Poiana C, Capatina C. Osteoporosis and fracture risk in patients with type 2 diabetes mellitus. Acta Endocrinol (Buchar). 2019;15(2):231-236. doi: https://doi.org/10.4183/aeb.2019.231
5. Valderrábano RJ, Linares MI. Diabetes mellitus and bone health: epidemiology, etiology and implications for fracture risk stratification. Clin Diabetes Endocrinol. 2018;4:9. doi: https://doi.org/10.1186/s40842-018-0060-9
6. Ahmad OS, Leong A, Miller JA, et al. A Mendelian Randomization Study of the Effect of Type-2 Diabetes and Glycemic Traits on Bone Mineral Density. J Bone Miner Res. 2017;32(5):1072-1081. doi: https://doi.org/10.1002/jbmr.3063
7. Zhu ZN, Jiang YF, Ding T. Risk of fracture with thiazolidinediones: an updated meta-analysis of randomized clinical trials. Bone. 2014;68:115-23. doi: https://doi.org/10.1016/j.bone.2014.08.010
8. Watts NB, Bilezikian JP, Usiskin K, et al. Effects of canagliflozin on fracture risk in patients with type 2 diabetes mellitus. J Clin Endocrinol Metab. 2016;101(1):157-166. doi: https://doi.org/10.1210/jc.2015-3167
9. Simanenkova A, Minasian S, Karonova T, et al. Comparative evaluation of metformin and liraglutide cardioprotective effect in rats with impaired glucose tolerance. Sci Rep. 2021;11(1):6700. doi: https://doi.org/10.1038/s41598-021-86132-2
10. Al-Awar A, Almási N, Szabó R, et al. Novel potentials of the DPP-4 inhibitor sitagliptin against ischemia-reperfusion (I/R) injury in rat ex-vivo heart model. Int J Mol Sci. 2018;19(10):3226. doi: https://doi.org/10.3390/ijms19103226
11. Yoda K, Imanishi Y, Yoda M, et al. Impaired response of FGF-23 to oral phosphate in patients with type 2 diabetes: a possible mechanism of atherosclerosis. J Clin Endocrinol Metab. 2012;97 (11):E2036-2043. doi: https://doi.org/10.1210/jc.2012-2024
12. Monami M, Dicembrini I, Antenore A, et al. Dipeptidyl peptidase-4 inhibitors and bone fractures: a meta-analysis of randomized clinical trials. Diabetes Care. 2011;34(11):2474-2476. doi: https://doi.org/10.2337/dc11-1099
13. Dombrowski S, Kostev K, Jacob L. Use of dipeptidyl peptidase-4 inhibitors and risk of bone fracture in patients with type 2 diabetes in Germany-a retrospective analysis of real-world data. Osteoporos Int. 2017;28(8):2421-2428. doi: https://doi.org/10.1007/s00198-017-4051-y
14. Fu J, Zhu J, Hao Y, et al. Dipeptidyl peptidase-4 inhibitors and fracture risk: an updated meta-analysis of randomized clinical trials. Sci Rep. 2016;6:29104. doi: https://doi.org/10.1038/srep29104
15. Zheng T, Yang L, Liu Y, et al. Plasma DPP4 activities are associated with osteoporosis in postmenopausal women with normal glucose tolerance. J Clin Endocrinol Metab. 2015;100(10):3862-3870. doi: https://doi.org/10.1210/jc.2015-2233
16. Kim SW, Cho EH. High levels of serum DPP-4 activity are associated with low bone mineral density in obese postmenopausal women. Endocrinol Metab (Seoul). 2016;31(1):93-99. doi: https://doi.org/10.3803/EnM.2016.31.1.93
17. Yu AS, Hirayama BA, Timbol G, et al. Functional expression of SGLTs in rat brain. Am J Physiol Cell Physiol. 2010;299(6):C1277-84. doi: 10.1152/ajpcell.00296.2010.
18. Tang HL, Li DD, Zhang JJ, et al. Lack of evidence for a harmful effect of sodium-glucose co-transporter 2 (SGLT2) inhibitors on fracture risk among type 2 diabetes patients: a network and cumulative meta-analysis of randomized controlled trials. Diabetes Obes Metab. 2016;18(12):1199-1206. doi: https://doi.org/10.1111/dom.12742
19. Ruanpeng D, Ungprasert P, Sangtian J, Harindhanavudhi T. Sodium-glucose cotransporter 2 (SGLT2) inhibitors and fracture risk in patients with type 2 diabetes mellitus: A meta-analysis. Diabetes Metab Res Rev. 2017;33(6):e2903. doi: https://doi.org/10.1002/dmrr.2903
20. Thrailkill KM, Clay Bunn R, Nyman JS, et al. SGLT2 inhibitor therapy improves blood glucose but does not prevent diabetic bone disease in diabetic DBA/2J male mice. Bone. 2016;82:101-107. doi: https://doi.org/10.1016/j.bone.2015.07.025
21. Thrailkill KM, Nyman JS, Bunn RC, et al. The impact of SGLT2 inhibitors, compared with insulin, on diabetic bone disease in a mouse model of type 1 diabetes. Bone. 2017;94:141-151. doi: https://doi.org/10.1016/j.bone.2016.10.026
Об авторах
Н. В. ТимкинаРоссия
Тимкина Наталья Владимировна; eLibrary SPIN: 6259-7745.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. В. Симаненкова
Россия
Симаненкова Анна Владимировна - кандидат медицинских наук; eLibrary SPIN: 3675-9216.
197341, Санкт-Петербург, ул. Аккуратова, д. 2
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Т. Л. Каронова
Россия
Каронова Татьяна Леонидовна - доктор медицинских наук, профессор; eLibrary SPIN: 3337-4071.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Т. Д. Власов
Россия
Власов Тимур Дмитриевич - доктор медицинских наук, профессор; eLibrary SPIN: 8367-1246.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. Ю. Семенова
Россия
Семенова Наталья Юрьевна - кандидат биологических наук ; eLibrary SPIN: 3566-4723.
Санкт-Петербург
Конфликт интересов:
none
А. А. Байрамов
Россия
Байрамов Алекбер Азизович - доктор медицинских наук; eLibrary SPIN: 9802-9988.
Санкт-Петербург
Конфликт интересов:
none
В. А. Тимофеева
Россия
Тимофеева Валерия Александровна; eLibrary SPIN: 5204-4164.
Санкт-Петербург
Конфликт интересов:
none
А. А. Шимшилашвили
Россия
Шимшилашвили Анжелика Анзоровна; eLibrary SPIN: 1645-0680.
Санкт-Петербург
Конфликт интересов:
none
Е. В. Шляхто
Россия
Шляхто Евгений Владимирович - доктор медицинских наук, профессор, академик РАН; eLibrary SPIN: 6679-7621.
Санкт-Петербург
Конфликт интересов:
none
Дополнительные файлы
|
|
1. Рисунок 1. Дизайн исследования | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(484KB)
|
Метаданные ▾ | |
|
|
2. Рис. 2. Динамика постпрандиальных значений гликемии в ходе эксперимента. Результаты представлены в виде медианы (25; 75)%. * — p<0,05 по сравнению с группой «Контроль». СТР — стрептозотоцин; ----- постпрандиальный уровень гликемии в норме. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(114KB)
|
Метаданные ▾ | |
|
|
3. Рис. 3. Показатели фосфорно-кальциевого обмена на фоне различных вариантов сахароснижающей терапии. А — концентрация общего кальция; Б — концентрация фосфора; В — кальций-фосфорное произведение; Г — концентрация фактора роста фибробластов-23. Результаты представлены в виде коробчатых графиков (box-plot), средняя линия соответствует медиане, центральная часть графика — нижнему (25%) и верхнему (75%) квартилям распределения, линии погрешностей — минимальному и максимальному значению в группе. FGF23 — фактор роста фибробластов-23. * — р<0,05 по сравнению с группой «Контроль»; § — р<0,05 по сравнению с группой «СД»; ¶ — р<0,05 по сравнению с группой «СД+СИТА», & — р<0,05 между группами «СД+ЭМПА» и «СД+КАНА». | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(297KB)
|
Метаданные ▾ | |
|
|
4. Рис. 4. Параметры костного обмена на фоне различных вариантов сахароснижающей терапии. А — концентрация остеокальцина; Б — концентрация остеопротегерина; В — концентрация лиганда активатора рецептора ядерного фактора каппа-бета (RANKL); Г — соотношение RANKL/остеопротегерин. Результаты представлены в виде коробчатых графиков (box-plot), средняя линия соответствует медиане, центральная часть графика — нижнему (25%) и верхнему (75%) квартилям распределения, линии погрешностей — минимальному и максимальному значению в группе. ОС — остеокальцин; OPG — остеопротегерин; RANKL — лиганд активатора рецептора ядерного фактора каппа-бета. * — р<0,05 по сравнению с группой «Контроль»; § — р<0,05 по сравнению с группой «СД»; ¶ — р<0,05 по сравнению с группой «СД+СИТА»; & — р<0,05 между группами «СД+ЭМПА» и «СД+КАНА». | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(272KB)
|
Метаданные ▾ | |
|
|
5. Рис. 5. Эпифизарная область кости с костными балками. А — «Контроль»; Б — «СД»; В — «СД+СИТА»; Г — «СД+ЭМПА»; Д — «СД+КАНА». Окраска гематоксилином-эозином, х100. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(778KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Тимкина Н.В., Симаненкова А.В., Каронова Т.Л., Власов Т.Д., Семенова Н.Ю., Байрамов А.А., Тимофеева В.А., Шимшилашвили А.А., Шляхто Е.В. Сравнительная оценка влияния ингибиторов натрий-глюкозного ко-транспортера 2 типа и ингибиторов дипептидилпептидазы 4 типа на параметры костного ремоделирования у крыс с экспериментальным сахарным диабетом 2 типа. Остеопороз и остеопатии. 2021;24(4):27-38. https://doi.org/10.14341/osteo12926
For citation:
Timkina N.V., Simanenkova A.V., Karonova T.L., Vlasov T.D., Semenova N.Yu., Bairamov А.A., Timofeeva V.A., Shimshilashvili A.A., Shlyakhto E.V. Comparative evaluation of Sodium-glucose co-transporter-2 inhibitors and dipeptidyl peptidase-4 inhibitors influence on bone turnover markers in rats with experimental type 2 diabetes mellitus. Osteoporosis and Bone Diseases. 2021;24(4):27-38. (In Russ.) https://doi.org/10.14341/osteo12926
Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































