Перейти к:
Интраоперационные осложнения у пациентов с системной красной волчанкой при выполнении тотального эндопротезирования тазобедренного сустава
https://doi.org/10.14341/osteo13169
Аннотация
ОБОСНОВАНИЕ. Системная красная волчанка (СКВ) — хроническое заболевание неизвестной этиологии, характеризующееся системным иммуновоспалительным поражением жизненно важных органов. Тяжелым осложнением СКВ являются асептические некрозы костей, которые характеризуются выраженным болевым синдромом, нарушением функции суставов, снижением качества жизни и инвалидизацией. Несмотря на то, что эндопротезирование тазобедренного сустава является технически отработанным методом оперативного лечения, пациенты с СКВ по-прежнему составляют группу повышенного риска развития осложнений на всех этапах периоперационного периода.
ЦЕЛЬ. Описать влияние СКВ на развитие интраоперационных осложнений при выполнении эндопротезирования тазобедренных суставов.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование включены 133 пациента с диагнозом СКВ, которым за период с 1998 по 2021 гг. выполнено тотальное эндопротезирование тазобедренного сустава. Все оперативные вмешательства выполнялись в травматолого-ортопедическом отделении НИИ ревматологии им. В.А. Насоновой. В группе больных СКВ преобладали женщины, соотношение женщин и мужчинам составило 7,3:1 соответственно. Средний возраст пациентов на момент операции — 36,6±12,6 года.
РЕЗУЛЬТАТЫ. Эндопротезирование тазобедренного сустава всем пациентам (n=133) выполняли стандартно в положении пациента на здоровом боку из переднебокового доступа Хардинга. В 75 случаях (56,3%) была выполнена дополнительная фиксация вертлужного компонента винтами. В 10 случаях был наложен серкляж на проксимальный отдел бедренной кости по причине перелома, возникшего при разработке костномозгового канала. Для уточнения факторов, влияющих на развитие интраоперационного перелома, пациенты с СКВ были разделены на 2 группы: первая группа (n=10) — с интраоперационным переломом, вторая (n=123) — без перелома. Проведена сравнительная характеристика первой и второй групп. Еще одно осложнение на этапе оперативного лечения — повышенный объем кровопотери, потребовавший переливания эритроцитарной взвеси. Таких пациентов было 54 (40,6%). В отношении пациентов с повышенным объемом кровопотери мы сравнили клинико-лабораторные характеристики больных непосредственно перед оперативным лечением с повышенным объемом кровопотери и без такового.
ЗАКЛЮЧЕНИЕ. В исследовании мы провели анализ полученных интраоперационных осложнений. Мы не получили подтверждение влияния суточной и кумулятивной доз ГК, а также степени активности и течения СКВ на риск интраоперационного перелома. Достоверно выше вероятность перелома оказалась у пациентов с исходно сниженной минеральной плотностью костной ткани.
В отношении повышенного объема кровопотери у пациентов с СКВ, достоверно выявлена связь с исходной анемией (сниженным уровнем гемоглобина и гематокрита) в предоперационном периоде (p<0,001).
Ключевые слова
Для цитирования:
Кушнарева И.Г., Попкова Т.В., Макаров М.А. Интраоперационные осложнения у пациентов с системной красной волчанкой при выполнении тотального эндопротезирования тазобедренного сустава. Остеопороз и остеопатии. 2024;27(3):12-19. https://doi.org/10.14341/osteo13169
For citation:
Kushnareva I.G., Popkova T.V., Makarov M.A. Intraoperative complications in patients with systemic lupus erythematosus during total hip replacement. Osteoporosis and Bone Diseases. 2024;27(3):12-19. (In Russ.) https://doi.org/10.14341/osteo13169
ОБОСНОВАНИЕ
Системная красная волчанка (СКВ) — заболевание неизвестной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител к различным компонентам клеточного ядра и развитием иммуновоспалительного повреждения внутренних органов [1][2].
Внедрение новых методов диагностики и лечения позволило увеличить выживаемость пациентов с СКВ. В то же время сохраняется большое число больных, нуждающихся в эндопротезировании тазобедренного сустава. Несмотря на то, что эндопротезирование тазобедренного сустава является технически отработанным методом оперативного лечения, пациенты с СКВ составляют группу повышенного риска развития осложнений на этапе предоперационной подготовки, во время операции, а также в послеоперационном периоде (раннем и позднем).
В исследованиях [3–5] было показано, что частота периоперационных осложнений выше, а длительность пребывания в стационаре после тотального эндопротезирования тазобедренного сустава у больных СКВ больше по сравнению с группой контроля (пациенты без СКВ). В то же время в работах [6][7] связь СКВ с послеоперационными осложнениями не установлена.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Цель работы — описать влияние СКВ на развитие интраоперационных осложнений при выполнении эндопротезирования тазобедренных суставов.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Время исследования. Период наблюдения 1998–2021 гг.
Изучаемые популяции (одна или несколько)
Изучались пациенты с системной красной волчанкой, которым было выполнено тотальное эндопротезирование тазобедренного сустава.
Критерии включения: взрослые пациенты (возраст более 18 лет), достоверно установленный диагноз СКВ согласно классификационным критериям, инструментально подтвержденное повреждение тазобедренного сустава.
Критерии исключения: высокая активность основного заболевания, наличие острого инфекционного процесса на период госпитализации, отсутствие возможности самостоятельной ходьбы с дополнительной опорой и без.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций) — сплошной.
Дизайн исследования
Было выполнено одноцентровое обсервационное одномоментное ретроспективное исследование за период с 1998 по 2021 гг.
Методы
В исследование включены 133 пациента с диагнозом СКВ согласно классификационным критериям ACR [8]. В группе больных СКВ преобладали женщины, соотношение женщин и мужчин — 7,3:1 соответственно. Средний возраст пациентов на момент операции составил 36,6±12,6 года. Активность СКВ оценивали по шкале SLEDAI 2K [9]. Преобладал хронический вариант течения болезни и низкая степень активности. АФС был диагностирован у 26 (19,5%) пациентов.
Все пациенты находились на терапии глюкокортикоидами (ГК). Средняя суточная доза ГК составила от 5 до 10 мг в сутки в пересчете на преднизолон; кумулятивная доза преднизолона имела разброс от 1800 мг до 62 655 мг. Оценивалась иммуносупрессивная терапия на момент оперативного лечения: гидроксихлорохин принимали 75 человек (56,3%), азатиоприн — 22 человека (16,5%), метотрексат — 6 человек (4,5%), микофенолата мофетил — 1 человек (0,7%). 4 пациента (3%) находились на генно-инженерной биологической терапии ритуксимабом. У данной группы пациентов оперативное лечение выполнялось спустя не менее 4 месяцев после очередного введения препарата.
Для оценки функции тазобедренного сустава использовали опросник Харриса (Harris Hip Score, HHS), разработанный для стандартизированной оценки дисфункции у пациентов после эндопротезирования тазобедренного сустава. В опросник включено 4 компонента: боль (1 пункт, 0–44 балла), функциональная активность (7 пунктов, 0–47 баллов), деформация (1 пункт, 0–4 балла) и объем движений (2 пункта, 0–5 баллов). Опросник Харриса заполняется пациентом и врачом, при этом чем выше суммарный балл, тем лучше результат. Максимальный возможный балл — 100, значения ниже 70 рассматриваются как неудовлетворительный результат, 70–80 — удовлетворительный, 80–90 — хороший и 90–100 — отличный [10]. Средний показатель функционального статуса тазобедренного сустава, оцениваемый по шкале Харрис, к моменту операции составлял 45,6±13,1 балла, что трактуется как неудовлетворительное состояние.
Интенсивность болевого синдрома оценивали по Визуально-аналоговой шкале боли [11]. Все больные с поражением тазобедренного сустава отмечали интенсивный болевой синдром механического характера, ограничение движений и снижение опороспособности конечности, ограничение самообслуживания.
У пациентов с СКВ оценивали частоту коморбидных заболеваний. Наиболее часто встречалось поражение сердечно-сосудистой системы: гипертоническая болезнь зафиксирована у 44 пациентов (33,1%), ишемическая болезнь сердца — у 8 больных (6%) СКВ.
Необходимо отметить, что у пациентов СКВ в анамнезе была бактериальная инфекция (туберкулез, фурункулез, постинъекционные абсцессы) у 25 пациентов (18,8%), поражение щитовидной железы наблюдалось у 13 больных (9,8%), хроническая болезнь почек зафиксирована у 9 (6,8%) пациентов, компенсированный сахарный диабет 2 типа встречался у 5 пациентов (3,8%), онкологическое заболевание зафиксировано у 6 (4,5%) пациентов с СКВ. Другие заболевания встречались достаточно редко, при этом какого-либо влияния на результаты хирургического лечения не оказывали.
Асептический некроз других локализаций был диагностирован у 15 (11,3%) пациентов, а сопутствующее снижение минеральной плотности костной ткани (МПКТ), зафиксированное по данным денситометрии проксимального отдела бедренной кости, — у 10 (7,5%) больных СКВ.
Клиническая характеристика пациентов представлена в таблицах 1 и 2.
Таблица 1. Клиническая характеристика пациентов с СКВ (n=133)
|
Показатели |
Кол-во |
% |
|
Пол: |
||
|
Мужской |
16 |
12,0 |
|
Женский |
117 |
88,0 |
|
Возраст, годы |
36,6±12,6 |
|
|
Длительность заболевания пациентов, мес |
89,0±87,2 мес |
|
|
Степень активности: |
||
|
Ремиссия (SLEDAI 2K — 0 баллов) |
16 |
12,0 |
|
Низкая (SLEDAI 2K — 1–4 баллов) |
80 |
60,2 |
|
Средняя степень активности (SLEDAI 2K — 5–10 баллов) |
37 |
27,8 |
|
Течение СКВ: |
||
|
Острое |
22 |
16,5 |
|
Подострое |
27 |
20,3 |
|
Хроническое |
84 |
63,2 |
Таблица 2. Клиническая характеристика пациентов с СКВ (n=133)
|
Проявления |
Абсолютное кол-во |
% |
|
Клинические проявления СКВ |
||
|
Поражение кожи |
90 |
67,7 |
|
Поражение слизистых оболочек |
24 |
18,0 |
|
Артриты |
100 |
75,2 |
|
Серозит (плеврит и/или перикардит) |
30 |
22,5 |
|
Люпус-нефрит (гистологически установленный) |
20 |
15,0 |
|
Поражение ЦНС |
18 |
13,5 |
|
Гематологические нарушения |
51 |
38,3 |
|
Иммунологические нарушения (аДНК, аКЛ) |
87 |
65,4 |
|
Антинуклеарный фактор |
133 |
100 |
|
Лечение на момент операции |
||
|
Гидроксихлорохин |
53 |
39,8 |
|
Азатиоприн |
22 |
16,5 |
|
Микофенолата мофетил |
1 |
0,7 |
|
Метотрексат |
6 |
4,5 |
|
Ритуксимаб |
4 |
3,0 |
Статистический анализ
Методы статистической обработки соответствовали дизайну исследования, что позволило с достаточной достоверностью решать поставленные задачи. Номинальные исчисляемые признаки (типа «да или нет»), анализировались таблицы сопряженности, коэффициент χ² Фишера-Пирсона и коэффициент сопряженности — φ. Порядковые исчисляемые признаки (типа «лучше — хуже») применялся τ коэффициент корреляции Кендела. Количественные показатели Rx,y, коэффициент корреляции Пирсона. Анализ статистической значимости средних значений при сравнении независимых выборок выполнялся в программе SPSS 22 — t-критерий Стьюдента.
РЕЗУЛЬТАТЫ
Эндопротезирование тазобедренного сустава всем пациентам (n=133) выполняли стандартно в положении пациента на здоровом боку из передне-бокового доступа Хардинга. Среднее время операции составило 94,9±23,96 мин. Состав операционных бригад был различен. Первым хирургом в бригаде всегда назначался один из опытных травматологов-ортопедов отделения. Попытка выявить корреляцию частоты осложнений и состава оперирующей бригады не проводилась.
В 75 случаях (56,3%) была выполнена дополнительная фиксация вертлужного компонента винтами. В 10 случаях был наложен серкляж на проксимальный отдел бедренной кости по причине перелома, возникшего при разработке костно-мозгового канала (рис. 1). У одного из 10 пациентов с переломом бедренной кости был выявлен также перелом дна вертлужной впадины, по причине которого была проведена пластика аутокостью.
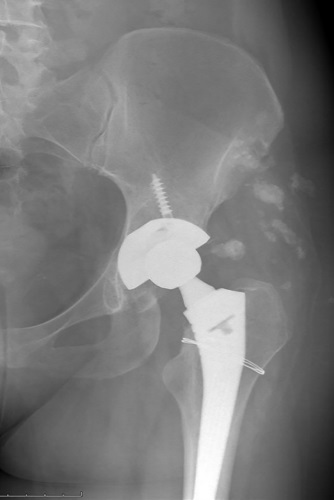
Рисунок 1. Рентгенограмма пациента с интраоперационным переломом проксимального отдела бедренной кости, фиксированным серкляжом.
Для уточнения факторов, влияющих на развитие интраоперационного перелома, пациенты с СКВ были разделены на 2 группы: первая группа (n=10) — с интраоперационным переломом, вторая (n=123) — без перелома (табл. 3). Проведена сравнительная характеристика первой и второй групп.
Таблица 3. Клинические характеристики больных СКВ с и без интраоперационного перелома
|
Признак |
Интраоперационный перелом n=10 |
Без интраоперационного перелома n=123 |
р |
|
Возраст |
43,0±11,7 |
35,7±12,7 |
0,087 |
|
Длительность заболевания, мес |
46,5±38,2 |
88,1±87,4 |
0,536 |
|
Средняя суточная доза ГК |
10,0±4,7 |
8,2±4,8 |
0,191 |
|
Кумулятивная доза ГК |
16007,2±10723,9 |
20641,6±15019,1 |
0,287 |
|
Асептический некроз других костей |
1 (10%) |
9 (9,7%) |
0,901 |
|
Сниженная МПКТ по данным денситометрии шейки бедренной кости |
10 (100%) |
28 (30,1%) |
0,014 |
|
Активность заболевания: |
|||
|
Ремиссия (SLEDAI 2K — 0 баллов) |
1 (10,0%) |
9 (7,3%) |
0,949 |
|
Низкая (SLEDAI 2K — 1–4 балла) |
6 (60,0%) |
52 (42,3%) |
|
|
Умеренная (SLEDAI 2K — 5-10 баллов) |
3 (30,0%) |
3 (2,4%) |
Средний возраст пациентов, у которых случился интраоперационный перелом, составил 43,0±11,7 года, что превышает показатель больных 2 группы, у которых не было перелома, — 35,7±12,7 года (р=0,087). В группе с интраоперационным переломом у 6 (60%) преобладала низкая степень активности по SLEDAI 2К.
Все пациенты находились на ГК терапии. Однако в нашем исследовании, несмотря на то, что медиана средней суточной дозы ГК в обеих группах была одинакова (10,0), а абсолютный показатель был больше у пациентов с осложнениями: 10,0±4,7 мг против 8,2±4,8 мг, факт приема ГК в большей суточной дозе не стал предиктором интраоперационного перелома (р=0,191). В отношении кумулятивной дозы ГК результат оказался обратный: среди больных, получивших осложнение, она составила 16007,2±10723,9 мг, у остальных пациентов — 20641,6±15019,1 мг.
Аналогично, мы не выявили в качестве фактора риска возможного интраоперационного перелома наличие асептического некроза нескольких костей (р=0,901). Однако выявилась зависимость полученных переломов и сопутствующей сниженной МПКТ: у всех 10 пациентов, по данным денситометрии по шейке бедренной кости, выполненной до операции, были значения, характерные для сниженной МПКТ (менее -1.0 SD от пиковой массы кости) (р=0,014).
Еще одно осложнение на этапе оперативного лечения — повышенный объем кровопотери, потребовавший переливания эритроцитарной взвеси. Таких пациентов было 54 (40,6%). В 41 случае (30,8%) оперативное лечение выполнялось с исходным уровнем гемоглобина у пациентов менее 120 г/л.
В отношении пациентов с повышенным объемом кровопотери мы сравнили клинико-лабораторные характеристики больных непосредственно перед оперативным лечением, с повышенным объемом кровопотери и без такового (табл. 4).
Таблица 4. Сравнительная характеристика пациентов с СКВ перед оперативным лечением с повышенным объемом кровопотери
|
Признак |
n=54 |
n=79 |
р |
|
Возраст |
37,1±12,4 |
36,5±12,9 |
0,142 |
|
Суточная доза ГК |
8,9±4,4 |
7,8±4,5 |
0,658 |
|
Прием антикоагулянтов/антиагрегантов |
5 (3,7%) |
11 (13,9%) |
0,257 |
|
АФС |
9 (6,7%) |
17 (21,5%) |
0,963 |
|
Объем кровопотери, мл |
619,4± 293,3 |
547,7±260,6 |
0,004* |
|
Исходный гемоглобин, г/л |
119,5±17,2 |
128,3±15,6 |
0,043* |
|
Гематокрит, % |
36,5±4,8 |
38,4±4,5 |
<0,001* |
|
Эритроциты, *10¹² |
4,2±0,5 |
4,4±0,6 |
0,007* |
|
Тромбоциты, *10⁹ |
255,1±74,4 |
256,3±68,1 |
0,505 |
|
АЧТВ, сек |
29,9±7,1 |
29,8±6,8 |
0,222 |
|
Фибриноген, г/л |
3,5±0,7 |
5,2±1,3 |
0,919 |
|
Протромбин по Квику, % |
114,2±20,4 |
110,4±17,3 |
0,075 |
|
Длительность операции, мин |
93,6±24,2 |
96,0±25,0 |
0,089 |
|
Интраоперационный перипротезный перелом |
4 (3,0%) |
6 (7,5%) |
0,855 |
Примечание: *р<0,05.
Объем кровопотери у исследуемой группы пациентов составил 619,4±293,3 мл, что больше объема остальных пациентов (547,7±260,6), которым переливание крови не проводилось.
Мы проанализировали все доступные показатели, которые могли бы повлиять на объем кровопотери. Исходно уровни гемоглобина и гематокрита были меньше у пациентов с СКВ, которым потребовалось впоследствии переливание крови: 119,5±17,2 г/л и 36,5±4,8 соответственно (р=0,043 и р<0,001).
При анализе таких факторов, как прием антиагрегантов и антикоагулянтов, наличие антифосфолипидного синдрома а также факта интраоперационного перелома, достоверного влияния на объем интраоперационной кровопотери не выявлено.
После операции всем больным проводили профилактику тромбоза, которая заключалась в ранней активизации после операции, эластическом бинтовании нижних конечностей либо ношении компрессионного трикотажа в течение 6 недель после операции, фармакологической терапии. В качестве фармакологической профилактики использовали низкомолекулярные гепарины (фраксипарин — 93 (69,9%) пациента, клексан — 1 (0,7%) пациент, ксарелто — 6 (4,5%) пациентов, прадакса — 20 (15,0%) пациентов, сулодексид — 3 (2,2%) пациента. У 10 пациентов не удалось установить вид антикоагулянтной терапии. Длительность профилактического курса антибиотиков составила 5–7 суток.
У всех пациентов было отмечено первичное заживление послеоперационной раны, без ранних инфекционных осложнений.
Отдаленные результаты операции оценивались как на очном приеме, так и посредством телефонного обзвона пациентов. По полученным данным, общий функциональный статус тазобедренного сустава по шкале Харрис более 90 баллов был зафиксирован у 87,3% пациентов. Оценка болевого синдрома по ВАШ 0–10 баллов зафиксирована у 84,1% пациентов (табл. 5).
Таблица 5. Отдаленные результаты
|
Признак |
Количество |
|
Ходьба с дополнительной опорой |
6,4% |
|
Харрис > 90 баллов |
87,3% |
|
ВАШ 0–10 мм |
84,1% |
ОБСУЖДЕНИЕ
В литературе нередко отмечается такое осложнение эндопротезирования, как интраоперационные переломы [12]. При использовании бесцементных эндопротезов геометрическая подгонка имплантата важна для достижения хорошей первичной стабильности. Таким образом, тщательная подготовка бедренного канала и выбор правильного размера и формы имплантата имеют важное значение для достижения стабильности, как в ранние сроки после операции, так и в отдаленном периоде. Именно на этапе разработки бедренного канала чаще всего происходит повреждение кости. Поскольку интраоперационные переломы бедренной кости приводят к ухудшению функциональных результатов и снижению удовлетворенности пациентов, важно определить группу риска и избежать осложнений [13]. В нашем исследовании переломы проксимального отдела бедра были зафиксированы у 10 пациентов. Таким образом, частота данного осложнения составила 7,5%, что превышает частоту в общей популяции в 1,5–2 раза [14].
Мы проанализировали характеристики пациентов, которые могли бы повлиять на развитие данного осложнения. Средний возраст пациентов, у которых случился интраоперационный перелом, был больше, по сравнению с другими больными (43,0±11,7 года и 35,7±12,7 года соответственно (р=0,087)). Все пациенты весь период заболевания находились на ГК терапии. Несмотря на высокую эффективность при СКВ, использование ГК имеет свои ограничения, в первую очередь обусловленные развитием побочных эффектов [15].
Одним из осложнений является ГК-индуцированный остеопороз [16].
Мы не доказали в качестве фактора риска возможного интраоперационного перелома наличие асептического некроза нескольких костей (р=0,901). Однако выявилась зависимость полученных переломов и сопутствующей сниженной МПКТ: у всех 10 пациентов, по данным денситометрии шейки бедренной кости, выполненной до операции, были значения, характерные для сниженной МПКТ менее -1.0 SD по шейке бедренной кости) (р=0,014).
Повышенное внимание заслуживают пациенты с сопутствующими заболеваниями. Много работ представлено в отношении высокого риска периоперационных осложнений, в частности интраоперационного перелома бедренной кости, у пациентов с ожирением [17–19].
Однако в одном метанализе [20], который оценивал осложнения более 580 тыс. пациентов с ожирением при тотальном эндопротезировании тазобедренного сустава, было выявлено, что риск перипротезных переломов не был значительно выше в группе с ожирением, чем у пациентов без ожирения. Также не нашел связи интраоперационных переломов с ожирением Kaspar Tootsi et al. [21]. Среди пациентов нашего исследования только у 1 был повышен ИМТ, а статистический анализ не подтвердил связь.
Объем кровопотери в исследуемой группе пациентов составил 619,4± 293,3 мл и был достоверно выше, чем у остальных пациентов (547,7±260,6). Исходно уровни гемоглобина и гематокрита были меньше у пациентов с СКВ, которым потребовалось впоследствии переливание крови: 119,5±17,2 г/л и 36,5±4,8 соответственно (р=0,043 и р<0,001). Как известно, при повреждении сосудистой стенки эритроциты крови выделяют ряд факторов (ADP, TxA2 и др.), вызывающих агрегацию тромбоцитов и формирование тромба. Кроме того, эритроциты связывают NO крови. При низком уровне эритроцитов количество выделяемых факторов уменьшается, а количество NO крови повышается, приводя к ухудшению агрегации тромбоцитов и, как следствие, к увеличению времени свертывания крови.
Об этом осложнении упоминается в нескольких литературных источниках. Так, Susan M. Goodman and Anne R. Bass (2018 г.) в своей работе показали, что у пациентов с СКВ, перенесших тотальное эндопротезирование, наблюдается увеличение частоты ранних послеоперационных осложнений [22], а Nathaniel R. Smilowitz et al. (2018 г.) отметили, что пациенты с СКВ особенно уязвимы к послеоперационной анемии, тромбоцитопении, переливанию крови [23]. Также, по утверждению Dorsch CA, Meyerhoff J. (1982 г.) и Shevchuk SV (2007 г.), СКВ сама по себе может индуцировать антитела к антикоагулянтным факторам и аномальную активацию, и агрегацию тромбоцитов [24][25]. По мнению Linge P. et al. и Takahashi H. et al., СКВ является предрасполагающим фактором к нарушениям свертываемости крови и, возможно, к более высокому риску кровотечений [26][27]. Данный факт находит подтверждение еще в одном исследовании, целью которого был обзор клинических исходов пациентов с СКВ, перенесших тотальное эндопротезирование тазобедренного сустава [28]. Оно показало, что периоперационный риск кровотечения у пациентов с СКВ выше, чем у больных с другими диагнозами. Более раннее исследование также продемонстрировало, что уровень гемоглобина после операции у пациентов с СКВ был ниже, чем у других пациентов. Авторы объясняли это более высоким уровнем кровопотери у пациентов с СКВ, по сравнению с другими пациентами [29].
При анализе таких факторов, как прием антиагрегантов и антикоагулянтов, наличие АФС, а также факт интраоперационного перелома, достоверного влияния на объем интраоперационной кровопотери не выявлено.
В отношении активности основного заболевания данные неоднозначные. Все описанные в литературе осложнения были выявлены у пациентов с высокой активностью (≥8 баллов SLEDAI). В нашем исследовании пациенты с высокой активностью не оперировались.
ЗАКЛЮЧЕНИЕ
В исследовании мы провели анализ полученных интраоперационных осложнений. Мы не получили подтверждения влияния суточной и кумулятивной доз ГК, а также степени активности и течения СКВ на риск интраоперационного перелома. Достоверно выше вероятность перелома оказалась у пациентов с исходно сниженной МПКТ. Рекомендуется проводить оперативное лечение на фоне антирезорбтивной терапии и продолжать ее не менее 6 месяцев после эндопротезирования.
В отношении повышенного объема кровопотери у пациентов с СКВ достоверно выявлена связь с исходной анемией (сниженным уровнем гемоглобина и гематокрита) в предоперационном периоде (p<0,001). При невозможности компенсировать хроническую анемию у пациентов с СКВ быть готовыми к необходимости переливания компонентов крови.
Больным СКВ необходим междисциплинарный подход на всех этапах периоперационного периода.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Кушнарева И.Г. — автор внес существенный вклад в изучение и анализ данных российской и зарубежной медицинской литературы, а также интерпретацию результатов, выполнил написание статьи; Попкова Т.В. — автор внес существенный вклад в изучение и анализ данных российской и зарубежной медицинской литературы, а также интерпретацию результатов, выполнил внесение в рукопись правки с целью повышения научной ценности статьи; Макаров М.А. — автор внес существенный вклад в изучение и анализ данных российской и зарубежной медицинской литературы, а также интерпретацию результатов, выполнил внесение в рукопись правки с целью повышения научной ценности статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Tsokos GC. Systemic lupus erythematosus. N Engl J Med. 2011;365(22):2110-2121. doi: https://doi.org/10.1056/NEJMra1100359
2. Kaul A, Gordon C, Crow MK, Touma Z, Urowitz MB, van Vollenhoven R, et al. Systemic lupus erythematosus. Nat Rev Dis Primers. 2016;2:16039. doi: https://doi.org/10.1038/nrdp.2016.39
3. Roberts JE, Mandl LA, Su EP, et al. Patients with Systemic Lupus Erythematosus Have Increased Risk of Short-term Adverse Events after Total Hip Arthroplasty. J Rheumatol. 2016;43(8):1498-1502. doi: https://doi.org/10.3899/jrheum.151373
4. Shah UH, Mandl LA, Mertelsmann-Voss C, Lee YY, Alexiades MM, Figgie MP, et al. Systemic lupus erythematosus is not a risk factor for poor outcomes after total hip and total knee arthroplasty. Lupus. 2015;24(9):900 doi: https://doi.org/10.1177/0961203314566635
5. Gholson JJ, Wilkinson BG, Brown TS, Gao Y, Dowdle SB, Callaghan JJ. Systemic lupus Erythematosus is a risk factor for complications in Total joint Arthroplasty. Iowa Orthopaedic J. 2018;38:183
6. Fein AW, Figgie CA, Dodds TR, et al. Systemic lupus erythematosus does not increase risk of adverse events in the first 6 months after total knee arthroplasty. JCR J Clin Rheumatol. 2016;22:355-9. doi: https://doi.org/10.1097/RHU.0000000000000435
7. Shah UH, Mandl LA, Mertelsmann-Voss C, et al. Systemic lupus erythematosus is not a risk factor for poor outcomes after total hip and total knee arthroplasty. Lupus. 2015;24:900-8. doi: https://doi.org/10.1177/0961203314566635
8. Yu C, Gershwin ME, Chang C. Diagnostic criteria for systemic lupus erythematosus: a critical review. J Autoimmun. 2014;48–49:10–3. doi: https://doi.org/10.1016/j.jaut.2014.01.004
9. Gladman DD, Ibañez D, Urowltz MB. Systemic lupus erythematosus disease activity index. In: Systemic Lupus Erythematosus. Elsevier; 2007:524-524. doi: https://doi.org/10.1016/B978-0-323-04434-9.50060-9
10. Harris WH. Traumatic arthritis of the hip after dislocation and acetabular fractures: treatment by mold arthroplasty. An end-result study using a new method of result evaluation. J Bone Joint Surg Am. 1969;51(4):737-755
11. Hawker G , Mian S, Kendzerska T, French M. Measures of adult pain: Visual Analog Scale for Pain (VAS Pain), Numeric Rating Scale for Pain (NRS Pain), McGill Pain Questionnaire (MPQ), Short-Form McGill Pain Questionnaire (SF-MPQ), Chronic Pain Grade Scale (CPGS), Short Form-36 Bodily Pain Scale (SF-36 BPS), and Measure of Intermittent and Constant Osteoarthritis Pain (ICOAP). Arthritis Care Res (Hoboken). 2011;63(11):S240-52. doi: https://doi.org/10.1002/acr.20543
12. Lamb JN, Matharu GS, Redmond A, Judge A, West RM, Pandit HG. Risk factors for intraoperative periprosthetic femoral fractures during primary total hip arthroplasty an analysis from the national joint registry for England and Wales and the Isle of Man. J Arthroplasty. 2019;34(12):3065–3073
13. Ferbert T, Jaber A, Gress N, Schmidmaier G, Gotterbarm T, Merle C. Impact of intraoperative femoral fractures in primary hip arthroplasty: a comparative study with a mid-term follow-up. HIP Int. 2020;30(5):544-551. doi: https://doi.org/10.1177/1120700019849911
14. Meek RMD, Norwood T, Smith R, Brenkel IJ, Howie CR. The risk of peri-prosthetic fracture after primary and revision total hip and knee replacement. J Bone Joint Surg Br. 2011;93-B(1):96-101. doi: https://doi.org/10.1302/0301-620X.93B1.25087
15. Арчакова Л.А., Кошелева Н.М., Смирнов А.В., Алекберова З.С. Быстрое снижение минеральной плотности костной ткани, развитие гормональной спондилопатии и аваскулярных некрозов тазобедренных суставов у больной системной красной волчанкой // Научно-практическая ревматология. 2004. — 4.
16. Беневоленская Л.И., Михайлов Е.Е. Руководство по остеопорозу. М.: Б И Н О М, 2003, 11
17. Arsoy D, Woodcock JA, Lewallen DG, Trousdale RT. Outcomes and complications following total hip arthroplasty in the super-obese patient, BMI > 50. J Arthroplast. 2014;29(10):1899e905
18. Davis AM, Wood AM, Keenan AC, Brenkel IJ, Ballantyne JA. Does body mass index affect clinical outcome postoperatively and at five years after primary unilateral total hip replacement performed for osteoarthritis? A multivariate analysis of prospective data. J Bone Joint Surg Br. 2011;93(9)
19. Issa K, Harwin SF, Malkani AL, Bonutti PM, Scillia A, Mont MA. Bariatric orthopaedics: total hip arthroplasty in super-obese patients (those with a BMI of >/¼50 kg/m2). J Bone Joint Surg Am. 2016;98(3):180e5
20. Onggo JR, Onggo JD, de Steiger R, Hau R. Greater risks of complications, infections, and revisions in the obese versus non-obese total hip arthroplasty population of 2,190,824 patients: a meta-analysis and systematic review. Osteoarthr Cartil. 2020. doi: https://doi.org/10.1016/j.joca.2019.10.005
21. Tootsi r, Lees L, Geiko B, Märtson A. Intraoperative complications in total hip arthroplasty using a new cementless femoral implant (SP-CL®). J Orthop Traumatol. 2020;21:8. doi: https://doi.org/10.1186/s10195-020-00548-6
22. Goodman SM, Bass AR. Perioperative medical management for patients with RA, SPA, and SLE undergoing total hip and total knee replacement: a narrative review. BMC Rheumatol. 2018;2(1):2. doi: https://doi.org/10.1186/s41927-018-0008-9
23. Smilowitz NR, Katz G, Buyon JP, Clancy RM, Berger JS. Systemic lupus erythematosus and the risk of perioperative major adverse cardiovascular events. J Thromb Thrombolysis. 2018;45(1):13-17. doi: https://doi.org/10.1007/s11239-017-1591-0
24. Dorsch CA, Meyerhoff J. Mechanisms of abnormal platelet aggregation in systemic lupus erythematosus. Arthritis Rheum. 1982;25(8):966-973. doi: https://doi.org/10.1002/art.1780250809
25. Shevchuk SV. State of adhesive-aggregative function of platelets in patients with systemic lupus erythematosus. Lik Sprava. 2007
26. Linge P, Fortin PR, Lood C, Bengtsson AA, Boilard E. The non-haemostatic role of platelets in systemic lupus erythema tosus. Nat Rev Rheumatol. 2018;14(4):195
27. Takahashi H, Moroi M. Antibody against platelet membrane glycoprotein VI in a patient with systemic lupus erythematosus. Am J Hematol. 2001;67(4):262
28. Cai Y, Ding Z, Rong X, Zhou ZK. Does systemic lupus erythematosus increase the risk of complications from total hip arthroplasty? BMC Musculoskelet Disord. 2021;22(1):457. doi: https://doi.org/10.1186/s12891-021-04316-3
29. Merayo-Chalico J, Gónzalez-Contreras M, Ortíz-Hernández R, Alcocer-Varela J, Marcial D, Gómez-Martín D. Total Hip Arthroplasty Outcomes: An 18-Year Experience in a Single Center: Is Systemic Lupus Erythematosus a Potential Risk Factor for Adverse Outcomes? J Arthroplasty. 2017;32(11):3462-3467. doi: https://doi.org/10.1016/j.arth.2017.06.021
Об авторах
И. Г. КушнареваРоссия
Кушнарева Ирина Геннадьевна
115522, Москва, Каширское шоссе, 34А
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Т. В. Попкова
Россия
Попкова Татьяна Валентиновна - д.м.н.
115522, Москва, Каширское шоссе, 34А
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
М. А. Макаров
Россия
Макаров Максим Анатольевич - к.м.н.
115522, Москва, Каширское шоссе, 34А
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Рентгенограмма пациента с интраоперационным переломом проксимального отдела бедренной кости, фиксированным серкляжом. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(120KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Кушнарева И.Г., Попкова Т.В., Макаров М.А. Интраоперационные осложнения у пациентов с системной красной волчанкой при выполнении тотального эндопротезирования тазобедренного сустава. Остеопороз и остеопатии. 2024;27(3):12-19. https://doi.org/10.14341/osteo13169
For citation:
Kushnareva I.G., Popkova T.V., Makarov M.A. Intraoperative complications in patients with systemic lupus erythematosus during total hip replacement. Osteoporosis and Bone Diseases. 2024;27(3):12-19. (In Russ.) https://doi.org/10.14341/osteo13169

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































