Перейти к:
Радиочастотная эхографическая мультиспектрометрия (REMS): описание метода и перспективы его использования в клинической практике
https://doi.org/10.14341/osteo13186
Аннотация
Остеопороз — системное заболевание скелета, характеризующееся снижением костной массы и изменением микроархитектоники ткани. Возникновение низкотравматических переломов вследствие остеопороза приводит к снижению качества и продолжительности жизни старшего населения, а также к увеличению затрат здравоохранения на лечение и реабилитацию данных пациентов, что делает остеопороз медико-социальной проблемой XXI века. Помимо профилактики и лечения, важное значение имеет ранняя и полноценная диагностика остеопороза для инициирования своевременной терапии. Наряду с существующими методами диагностики остеопороза до развития перелома: оценка риска патологических переломов (FRAX), измерение минеральной плотности кости (МПК) двухэнергетической рентгеновской остеоденситометрией (DXA), постоянно развиваются новые технологии, в том числе учитывающие низкую доступность и малую мобильность DXA. Инновационным методом оценки плотности костной ткани и риска переломов является радиочастотная эхографическая мультиспектрометрия — неионизирующий метод сканирования осевых участков скелета — позвоночника и бедра. Настоящий обзор суммирует проведенные исследования и накопленные знания по использованию REMS в клинической практике.
Ключевые слова
Для цитирования:
Жданова А.С., Телегина М.А., Артемова А.М., Белая Ж.Е. Радиочастотная эхографическая мультиспектрометрия (REMS): описание метода и перспективы его использования в клинической практике. Остеопороз и остеопатии. 2025;28(1):21-27. https://doi.org/10.14341/osteo13186
For citation:
Zhdanova A.S., Telegina M.А., Artemova A.M., Belaya Zh.E. Radiofrequency echographic multi spectrometry (REMS): description of the method and perspective for its usage in clinical practice. Osteoporosis and Bone Diseases. 2025;28(1):21-27. (In Russ.) https://doi.org/10.14341/osteo13186
ВВЕДЕНИЕ
Остеопороз (ОП) — метаболическое заболевание скелета, характеризующееся снижением костной массы, нарушением микроархитектоники костной ткани и, как следствие, переломами при минимальной травме [1]. На фоне остеопороза патологические переломы могут возникнуть при падении с высоты собственного роста, кашле, чихании, неловком движении без видимого травматического повреждения [2]. Остеопоротические переломы вносят существенный вклад в инвалидизизацию и смертность населения старшей возрастной группы.
С учетом прогнозируемого роста продолжительности жизни в России в ближайшие годы будет наблюдаться рост случаев патологических переломов. Так, например, к 2035 году у женщин число случаев перелома проксимального отдела бедренной кости вырастет на 43%, у мужчин — на 36% [3], в связи с чем остеопороз становится медицинской, социальной и экономической проблемой для здравоохранения Российской Федерации.
В качестве диагностики остеопороза рекомендуется использовать один из трех способов согласно современным клиническим рекомендациям [4]:
1. Наличие патологических переломов крупных костей скелета (бедренной кости, тел(а) позвонков(-а), множественных переломов) в анамнезе или выявленных при обследовании, независимо от результатов рентгеноденситометрии или расчета FRAX® (при условии исключения других заболеваний скелета).
2. Наличие высокой индивидуальной 10-летней вероятности основных патологических переломов (результат оценки FRAX® соответствует Российскому порогу вмешательства и/или превышает его) независимо от показателя рентгеноденситометрии.
3. Снижение минеральной плотности кости (МПК), измеренной в ходе двухэнергетической рентгеноденситометрии (DXA), на 2,5 и более стандартных отклонений (SD) по Т-критерию в шейке бедренной кости, и/или в целом в проксимальном отделе бедренной кости, и/или в поясничных позвонках (L1-L4, L2-L4) у женщин в постменопаузе и мужчин старше 50 лет.
Золотым стандартом диагностики и оценки эффективности терапии остепороза является определение МПК двухэнергетической рентгеновской абсорбциометрией осевого скелета человека. Этот метод основан на измерении поглощения рентгеновских лучей ионами кальция в костях, что позволяет определить минеральную плотность кости в единицах г/см². Преимуществом метода является измерение МПК вне зависимости от толщины мягких тканей за счет использования двух уровней энергии [5].
При обследовании методом DXA проводят анализ показателей минерализации кости:
- Костный минеральный компонент (bone mineral content, BMC) — определяется длиной сканируемого пути (г/cм), отражает количество минерализованной ткани (г) при сканировании костей.
- МПК (или bone mineral density, BMD) — количество минерализованной костной ткани в сканируемой площади (г/cм²).
При оценке результатов денситометрии не рекомендуется использовать отдельное тело позвонка, вертел, область Варда или фрагмент лучевой кости [6].
Дополнительным параметром оценки микроархитектоники кости при проведении DXA является трабекулярный костный индекс (TBS), который совместно с алгоритмом FRAX позволяет повысить чувствительность метода для выявления пациентов из групп с высоким риском переломов [6].
На основании измерения МПК проводились исследования существующих препаратов для лечения остеопороза, в связи с чем метод рентгеновской двухэнергетической абсорбциометрии стал ключевым в диагностике и динамическом наблюдении данных пациентов. Вместе с тем DXA имеет ряд ограничений, в первую очередь ввиду высокой стоимости аппарата, крупногабаритных размеров, необходимости наличия отдельного оборудованного помещения и наличия лучевой нагрузки для пациента [7].
Ввиду технических ограничений рентгеновского денситометра по весу и росту человека, диагностика пациентов выше 196 см и весом более 120 кг не осуществима. Проведение исследования не учитывает ситуации, когда число поясничных позвонков отлично от 5 (сакроилизация, люмбализация, добавочные ребра, наличие 6 поясничных позвонков), что затрудняет применение стандартного анализа в указанных случаях. Кроме того, результат денситометрии зависит от правильности расположения пациента, что диктует необходимость наличия у медицинского сотрудника соответствующей подготовки [8][9].
Дополнительными ограничениями для проведения DXA являются беременность, наличие у пациента ортопедических конструкций, недавно проведенное контрастное исследование КТ или ПЭТ-КТ [7].
Кроме того, при рекомендуемых 11 аппаратах на 1 млн населения [10] в Российской Федерации обеспеченность составляет лишь 2,9 на 1 млн населения [11]. В первую очередь это связано с высокой стоимостью оборудования, что делает его недоступным в большом числе регионов страны.
Постоянно развиваются и становятся предметом активных обсуждений новые технологии оценки минеральной плотности и/или качества кости. Предлагается использовать как рентгенологические, так и ультразвуковые методы исследования: количественная компьютерная томография (QCT), периферическая QCT (pqct, которая измеряет микроархитектуру кости в периферийных участках, таких как лучевая кость и большеберцовая кость), pqct высокого разрешения (HR-pqct), количественное ультразвуковое исследование (QUS) и магнитно-резонансная томография (MRI) [11][12]. Все вышеперечисленные методы имеют различные ограничения, которые включают ионизирующее излучение (методы компьютерной томографии), низкую переносимость, ограниченный доступ/доступность в клинической практике (особенно для тех, которые используются только в исследовательских условиях: pqct и MRI), длительное время сбора данных (MRI) и технические/зависящие от оператора вариации (QUS) [13].
Очевидным ограничением является недостаточный объем проспективных исследований, связывающих результаты этих исследований с фактом перелома и эффективности терапии остеопороза. Вместе с тем демографическая ситуация и увеличение продолжительности жизни населения приводят к росту частоты остеопоротических переломов, что подчеркивает важность профилактики и ранней диагностики заболевания для проведения своевременного лечения пациентов с высоким риском переломов.
Целью настоящего обзора является анализ результатов исследования, продемонстрировавших возможности технологии REMS для оценки плотности костной ткани.
РАДИОЧАСТОТНАЯ ЭХОГРАФИЧЕСКАЯ МУЛЬТИСПЕКТРОМЕТРИЯ (REMS): ФИЗИКА ПРОЦЕССА
Технология позволяет оценить радиочастотные сигналы, отражащиеся от костной ткани, с последующим автоматизированным анализом результатов с эталонной базой данных NHANES для соответствующего пола, возраста, индекса массы тела [14, 15].
Сравнение спектральных характеристик проводится с моделями пациентов с остеопорозом, остеопенией и нормой [16].
При проведении исследования сканированию подвергаются аксиальные участки скелета, как и при рентегновской денситометрии — проксимальный отдел бедренной кости и поясничные позвонки. Визуализация осуществляется путем сканирования искомых областей датчиком 3,5 МГц через переднюю брюшную стенку и/или область верхней трети бедра с подбором параметров фокуса и глубины в зависимости от конституции пациента (рис. 1) [17].
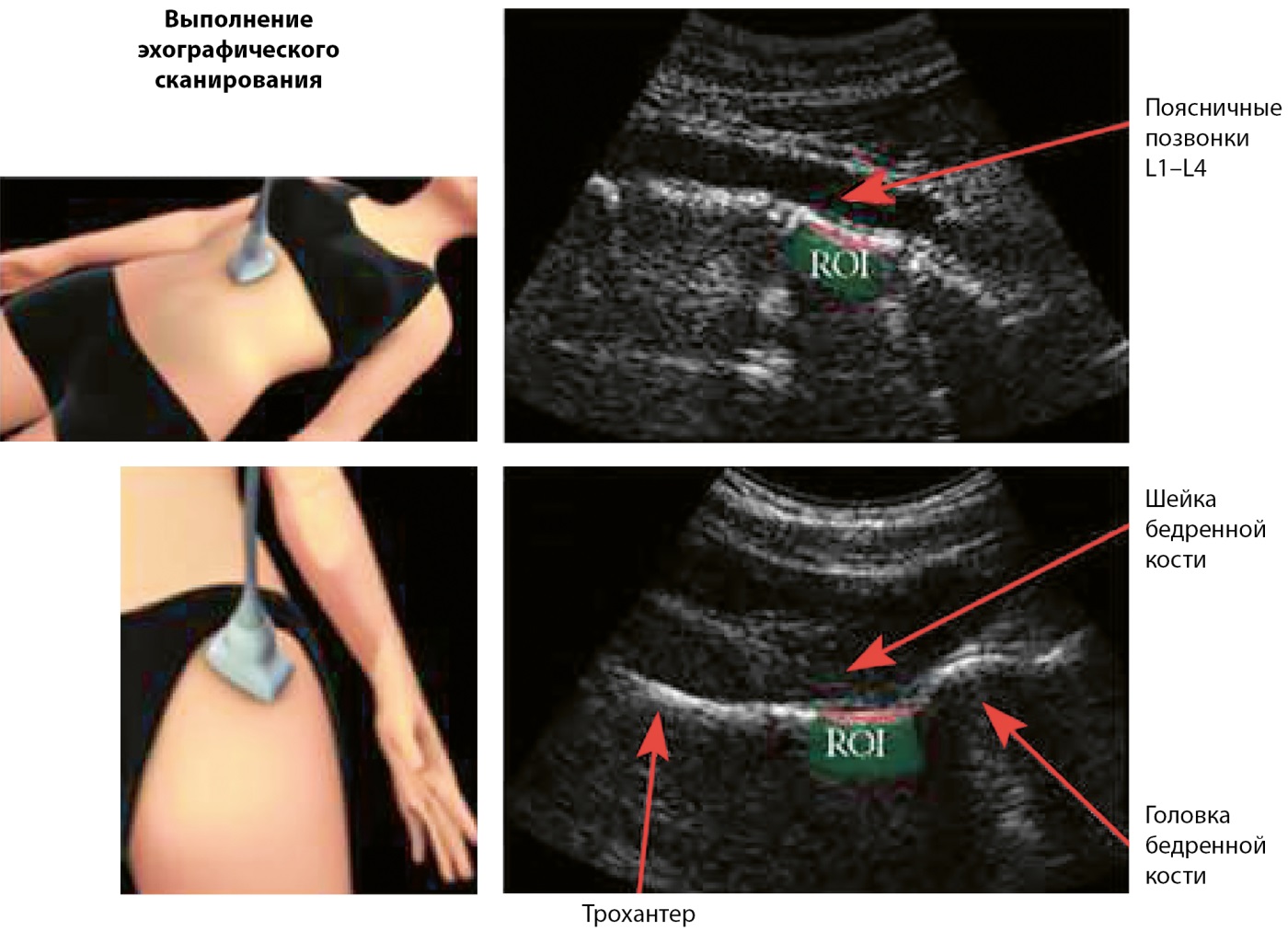
Рисунок 1. Радиочастотная эхографическая мультиспектрометрия. Технология сканирования.
Ценной возможностью метода является исключение артефактов (остеофитов, кальциноза) в процессе обследования пациента путем идентификации необработанных сигналов и последующим их удалением [17].
Конечный результат обследования отображается в виде показателей Osteoporosis Score (OS) и Fragility Score (FS). OS характеризует кость как остеопорозную, остеопеническую или норму, выражаясь в виде Т и Z-критериев.
FS или «индекс хрупкости» — количественный параметр 5-летнего риска перелома в числовом значении от 1 до 100, который рассчитывается программой при сравнении полученных данных с базой данных пациентов без переломов и с наличием низкотравматических переломов в анамнезе. Корреляция показателя с риском десятилетней вероятности остеопоротического перелома по FRAX позволяет расссматривать его как самостоятельную характеристику состояния костной ткани [18–20].
Технические характеристики аппарата REMS определяют отличительные особенности среди других методов оценки состояния костной ткани [6]:
- отсутствие лучевой нагрузки для пациента и сотрудника и, как следствие, возможность проведения исследования в любом помещении, в том числе вне медицинской организации;
- ввиду сканирования позвонков через переднюю брюшную стенку ограничение исследования для пациентов с индексом массы тела более 40 кг/м²;
- с учетом отсеивания артефактов возможность проведения сканирования в группе пациентов с наличием металлоконструкций, кальцификацией брюшного отдела аорты;
- оценка качества костной ткани, независимо от результатов МПК, при расчете FS как дополнительного параметра.
КЛИНИЧЕСКИЕ РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ REMS ДЛЯ ДИАГНОСТИКИ ОСТЕОПОРОЗА
В октябре 2018 г. технология радиочастотной эхографической мультиспектрометрии была разрешена к применению Food and Drugs Administration (FDA) США. В настоящее время методика зарегистрирована в 49 странах, в том числе в РФ с 2020 г. [21].
Одним из первых исследований по оценке валидности REMS было одноцентровое исследование Casciaro S. с соавт. в 2016 г., по результатам которого в группе из 377 женщин ревматологического отделения в возрасте 61–70 лет конкордантность REMS и DXA в бедренной кости составила 94,7% [22].
Сопоставимость диагностической применимости REMS по сравнению с DXA позже была проанализирована в европейском многоцентровом клиническом исследовании, опубликованном в 2021 г. Среди 4307 пациентов европеоидной расы в возрасте от 30 до 90 лет было проведено 4245 сканирований поясничного отдела позвоночника и 4271 сканирование шейки бедренной кости. За исключением 340 (8%) и 408 (9,6%) ошибочных отчетов DXA для шейки бедренной кости и поясничного отдела позвоночника соответственно и 323 (7,6%) и 373 (8,8%) ошибочных REMS-сканирования, 360 случаев сканирования шейки бедренной кости и 3464 случая сканирования поясничного отдела позвоночника были использованы для анализа функциональных характеристик [23].
Опубликованные результаты исследования продемонстрировали высокую чувствительность (90,9%) и специфичность (95,1%) в рамках диагностики остеопороза для поясничного отдела позвоночника и шейки бедренной кости (90,4% и 95,5% соответственно), положительную прогностическую значимость в диапазоне 82–86% и отрицательную прогностическую значимость более 97% для обоих референтных анатомических участков.
Авторы работы опубликовали данные по достойной корреляции (r=0,93 по шейке бедра и r=0,94 по поясничному отделу позвоночника) между результатами измерения МПК методами DXA и REMS в исследуемой популяции.
С учетом анамнестических данных пациентов (с наличием низкотравматического перелома и без него) полученные Т-показатели методом DXA в меньшей степени отражали перенесенные переломы, чем результаты REMS [23].
В исследовании Giovanni Adam с соавт. [24] в течение 5 лет изучалась возможность выявления пациентов с высоким риском низкотравматического перелома с использованием значений T-критерия методом REMS. В исследование было включено 1516 женщин в возрасте 30–90 лет. Всем исследуемым было проведено сканирование аксиальных участков скелета двуми методами: DXA и REMS.
За период наблюдения частота патологических переломов составила 14,0%. Было отмечено 192 перелома: 14,6% запястья, 12,5% позвонков, 11,8% плечевой кости, 11,1% бедра, 7,7% предплечья, 6,9% голеностопного сустава, 4,6% таза, 22,3% других локализаций.
По данным исследования, чувствительность и специфичность REMS в отношении сканирования позвонков составила 92,4% и 94,4%, для бедренной кости 90,9% и 96,2% соответственно. Полученные результаты обследования выявили связь между более низкими значениями Т-критерия и более высокой частотой переломов. У 39,5% пациентов с остеопорозом наблюдались переломы в течение всего периода наблюдения при DXA, против 43,7% — при REMS.
В заключении исследования авторы выделяют Т-критерий REMS в качестве прогностического фактора возникновения случайных патологических переломов среди женщин (двойной риск перелома на единицу снижения), что дает дополнительную возможность диагностики остеопороза в клинической практике.
Самостоятельным показателем качества костной ткани является «индекс хрупкости» — Fragility score. По результатам проведенного анализа 1989 случаев пациентов с остеопорозом, Paola Pisani и соавт. была продемонстрирована дополнительная возможность выявления пациентов высокого риска перелома в краткосрочной перспективе благодаря использованию специфических пороговых значений FS [25].
Вероятность и причины ошибочных результатов сканирования методом REMS были проанализированы с учетом внутри- и межисследовательской воспроизводимости данных в итальянском исследовании 2019 г. [26].
Исследование проводилось с привлечением 1914 женщин в постменопаузе от 51 до 70 лет и индексом массы тела (ИМТ) менее 40 кг/м². Каждый случай включал повторный анализ (одного оператора и разных операторов) методом REMS для исключения ошибок сканирования.
По результатам двойной проверки разными операторами каждого случая было выделено 280 ошибочных сканирований методом REMS позвоночника (18%) и 205 неверных сканов проксимального отдела бедра (12%). После перекрестной проверки и исключения некорректных данных было проанализировано 1195 позвоночных и 1373 сопоставимых бедренных случая.
Неправильно подобранные параметры фокуса и глубины сканирования отмечены как основные ошибки при проведении исследования. Отдельное внимание авторов уделяется должному обучению оператора, которое необходимо для качественного выполнения данного метода обследования.
После исключения 30% ошибочных результатов сканирования из исследования, чувствительность REMS при разделении пациентов с остеопорозом и без составила 91,7% для позвоночника и 91,5% для бедра, специфичность — 92% и 91,8% соответственно [26].
Изучение взаимосвязи между REMS и DXA описано в сравнительном исследовании пациентов с первичным остеопорозом и остеопорозом, связанным с иммобилизацией, в общей сложности у 175 пациентов. Диагностическое соответствие составило 63% (каппа Коэна = 0,31) у пациентов с первичным остеопорозом и 13% (каппа Коэна = -0,04) у пациентов с остеопорозом, связанным с иммобилизацией. В группе пациентов с первичным остеопорозом (n=140) не было выявлено существенной разницы между показателями МПК шейки бедра и общей МПК бедренной кости (средняя разница между REMS и DXA: -0,015 г/см² и — 0,004 г/см² соответственно), подтверждая хорошее соответствие между REMS и DXA у пациентов с первичным остеопорозом; однако имелась значительная разница в показателях МПК, связанных с иммобилизацией (n=35, средние различия составляют 0,136 г/см² и 0,236 г/см² соответственно), демонстрирующая плохую диагностическую согласованность в этой меньшей популяции [27].
Особое значение приобретает обследование пациентов с сахарным диабетом 2 типа (СД2) в связи с ростом заболеваемости и прогрессирующем числом осложнений.
В отличие от лиц с сахарным диабетом 1 типа (СД1), пациенты с СД2 имеют нормальную или даже высокую минеральную плотности кости, однако риск переломов любой локализации у них в 3 раза выше, чем в общей популяции [28], что связано с непосредственным изменением «качества» костной ткани.
Ложное завышение показателей МПК методом DXA у пациентов с СД2 развивается вследствие дегенеративных изменений, связанных с остеоартритом, остеофитами, кальцификацией сосудов или переломами позвонков, что может приводить к значительному занижению риска переломов у таких пациентов [29].
В работе Carla Caffarelli были проанализированы возможности применения REMS для диагностики остеопороза в группе пациентов с СД2 [29].
В исследовании приняли участие 90 женщин европиодной расы в возрасте 50–80 лет с СД2 и 90 женщин без нарушений углеводного обмена в качестве контрольной группы. Пациентки с морбидным ожирением, хронической болезнью почек, патологией кальций-фосфорного обмена, уровнем гликированного гемоглобина более 8,5% были исключены.
Показатели DXA в ходе наблюдения были выше у женщин с СД, чем у лиц без диабета. Результаты REMS, напротив, были ниже у женщин с СД, чем у группы сравнения, но различия не достигли статистической значимости.
В исследовании Fiorella A. Lombardi и соавт. было проведено сравнение значений FS среди группы пациентов с СД2 с контрольной здоровой группой для оценки качества костной ткани. Средние значения FS, измеренные с помощью REMS в поясничном отделе позвоночника, были значительно выше в когорте пациентов с СД2 (53,4±16,8), чем у здоровой контрольной группы (50,8±17,7) [30].
Использование радиочастотной эхографической мультиспектрометрии в рамках вторичного остеопороза проанализировано в когорте пациентов с акромегалией в исследовании Rolla M. [31].
В исследование были включены 33 пациента с акромегалией (лекарственно контролируемой и в стадии ремиссии после хирургического лечения) и 24 здоровых человека контрольной группы. Данные REMS по минеральной плотности кости поясничного отдела позвоночника и шейки бедренной кости не показали существенных различий между группами. Аналогичным образом не было выявлено существенных различий в МПК методом DXA между пациентами с лекарственно-контролируемой акромегалией и после хирургического лечения. Отдельное внимание авторы уделили положительной корреляции между концентрацией ИФР-1 и МПК, измеренной с помощью REMS и DXA.
Валидность использования REMS у мужчин также была проанализирована в исследовании Adami Giovanni у 603 белых мужчин в возрасте от 30 до 90 лет. Результаты обследования показали значимую корреляцию между значениями T-score, измеренными по REMS и DXA (r=0,91, p<0,0001), для поясничного отдела позвоночника и шейки бедра (r=0,90, p<0,0001) [32].
Экспертами Европейского общества клинических и экономических аспектов остеопороза, остеоартрита и заболеваний опорно-двигательного аппарата (ESCEO) методика REMS рассматривается как потенциальный инструмент в диагностике остеопороза и оценке качества костной ткани с учетом ее технических возможностей и результатов проведенных исследований по сопоставимости диагностической точности в сравнении с DXA [33].
ЗАКЛЮЧЕНИЕ
Технические характеристики и особенности программного обеспечения REMS (отсутствие лучевой нагрузки, компактность, мобильность, расчет Fragility score) могут дать дополнительные возможности в рамках диагностики остеопороза, обладая при должном качестве выполнения обследования высокой чувствительностью и специфичностью при сравнении с DEXA. Вместе с тем метод сохраняет недостатки оператор-зависимости ультразвуковых технологий.
Перспективы внедрения REMS в рамках первичной амбулаторной помощи могут способствовать раннему выявлению остеопороза и предупреждению появления патологических переломов в популяции.
Исследование пациентов с СД2 с помощью метода REMS представляет интерес с точки зрения особенности изменения костной структуры при повышении или нормальном значении МПК, что требует проведения углубленного наблюдательного исследования.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена в рамках государственного задания №124020700097-8.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Жданова А.С. — анализ полученных данных, написание текста; Телегина М.А. — сбор и обработка материалов; Артемова А.М. — написание статьи; Белая Ж.Е. — концепция и дизайн исследования, внесение существенной правки с целью повышения научной ценности статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Hernlund E, Svedbom A, Ivergård M, et al. Osteoporosis in the European Union: a compendium of aetiology, diagnosis and management. Archives of Osteoporosis. 2013;8(1):1-36. doi: https://doi.org/10.1007/s11657-013-0159-0
2. Cummings SR, Melton LJ. Epidemiology and Outcomes of Osteoporotic Fractures. The Lancet. 2002;359(9319):1761-1767. doi: https://doi.org/10.1016/S0140-6736(02)08657-9
3. Лесняк О.М., Ершова О.Б., Белова К.Ю и др. Эпидемиология остеопоротических переломов в Российской Федерации и российская модель FRAX. // Остеопороз и остеопатии. — 2014. — Т.17. — №3. — С. 3-8.
4. Белая Ж.Е., Белова К.Ю., Бирюкова Е.В. и др. Федеральные клинические рекомендации по диагностике, лечению и профилактике остеопороза. // Остеопороз и остеопатии. — 2021. — Т.24. — №2. — С.4-47.
5. Шарашкина Н.В., Наумов А.В., Дудинская Е.Н. и др. Консенсус экспертов: Диагностика остеопороза и саркопении у пациентов пожилого и старческого возраста. // Терапия. — 2023. — №10. — С.7-20.
6. Belaya Z, Rozhinskaya L, Dedov I, et al. A summary of the Russian clinical guidelines on the diagnosis and treatment of osteoporosis. Osteoporos International. 2023;34(3):429-447. doi: https://doi.org/10.1007/s00198-022-06667-6
7. Sarecka-Hujar B. The Role of DXA in the Assessment of Bone Mineral Density. Wiadomości Lekarskie. 2016;69(1):57-63
8. Beck T. Measuring the structural strength of bones with dualenergy X-ray absorptiometry: principles, technical limitations, and future possibilities. Osteoporos International. 2003;14(5):81–8. doi: https://doi.org/10.1007/s00198-003-1478-0
9. Петряйкин А.В., Низовцова Л.А., Артюкова З.Р. и др. Остеоденситометрия: методические рекомендации. Серия «Лучшие практики лучевой и инструментальной диагностики». — Вып. 88. — 2-е изд., перераб. и доп. М.: ГБУЗ «НПКЦ дит ДЗМ»; 2020; 60.
10. Kanis JA, Johnell O. Requirements for DXA for the management of osteoporosis in Europe. Osteoporos International. 16(3):229– 238. doi: https://doi.org/10.1007/s00198-004-1811-25
11. Лесняк О.М., Баранова И.А., Белова К.Ю. и др. Остеопороз в Российской Федерации: эпидемиология, медико-социальные и экономические аспекты проблемы (обзор литературы). // Травматология и ортопедия России. — 2018Т. 24. — №1 — С.155–168.
12. Nicholas R Fuggle, Elizabeth M Curtis, Kate A Ward et al. Fracture prediction, imaging and screening in osteoporosis. Nature Reviews Endocrinology. 2019;(15):535–547. doi: https://doi.org/10.1038/s41574-019-0220-8
13. Diez-Perez A, Brandi ML, Al-Daghri N, et al. Radiofrequency echographic multispectrometry for the in-vivo assessment of bone strength: state of the art-outcomes of an expert consensus meeting organized by the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal diseases (ESCEO). Aging Clin Exp Res. 2019;(31):1375–1389. doi: https://doi.org/10.1007/s40520-019-01294-4
14. Conversano F, Franchini R, Greco A, et al. A novel ultrasound methodology for estimating spine mineral density. Ultrasound Med. Biol. 2015;41(1):281–300. doi: https://doi.org/10.1016/j.ultrasmedbio.2014.08.017
15. Casciaro S, Peccarisi M, Pisani P, et al. An advanced quantitative echosound methodology for femoral neck densitometry. Ultrasound Med. Biol. 2016;42(60):1337–1356. doi: https://doi.org/10.1016/j.ultrasmedbio.2016.01.024
16. Casciaro S, Conversano F, Pisani P, et al. New perspectives in echographic diagnosis of osteoporosis on hip and spine. Clin. Cases Miner. Bone Metab. 2015;12(2):142–150. doi: https://doi.org/10.11138/ccmbm/2015.12.2.142
17. Лесняк О.М. Новый метод оценки прочности костной ткани: радиочастотная эхографическая мультиспектрометрия. // Эффективная фармакотерапия. — 2020. — Т.16. — №19. — С. 38–44.
18. Caffarelli C, Tomai Pitinica MD, Francolini V, et al. REMS technique: future perspectives in an Academic Hospital. Clin. Cases Miner. Bone Metab. 2018;15(2):163–165. doi: https://doi.org/10.11138/ccmbm/2018.15.2.163
19. Greco A, Pisani P, Conversano F, Soloperto G. Ultrasound fragility score: an innovative approach for the assessment of bone fragility. Measurement. 2017;101:236–242. doi: https://doi.org/10.1016/j.measurement.2016.01.033
20. Pisani P, Greco A, Conversano F, et al. A quantitative ultrasound approach to estimate bone fragility: a first comparison with dual X-ray absorptiometry. Measurement. 2017;101:243–249. doi: https://doi.org/10.1016/j.измерение.2016.07.033
21. Иванов С.Н. REMS — денситометрия. Расширение возможностей диагностики и прогнозирования рисков переломов. // Opinion Leader. — 2021. — Т.45. — №4 — С.78-87.
22. Sergio Casciaro, Marco Peccarisi , Paola Pisan, et al. An Advanced Quantitative Echosound Methodology for Femoral Neck Densitometry. Ultrasound in Medicine Biology. 2016;42(6):1337-56. doi: https://doi.org/10.1016/j.ultrasmedbio.2016.01.024
23. Cortet B, Dennison E, Diez-Perez A, et al. Radiofrequency Echographic Multi Spectrometry (REMS) for the diagnosis of osteoporosis in a European multicenter clinical context. Bone. 2021. doi: https://doi.org/10.1016/j.bone.2020.115786
24. Adami G, Arioli G, Bianchi G, et al. Radiofrequency echographic multi spectrometry for the prediction of incident fragility fractures: A 5-year follow-up study. Bone. 2020;134:115297. doi: https://doi.org/10.1016/j.bone.2020.115297
25. Paola Pisani , Francesco Conversano , Maurizio Muratore, et al. Fragility Score: a REMS-based indicator for the prediction of incident fragility fractures at 5 years. Aging Clin Exp Res. 2023;35(4):763-773. doi: https://doi.org/10.1007/s40520-023-02358-2
26. M Di Paola, D Gatti, O Viapiana, et al. Radiofrequency echographic multispectrometry compared with dual X-ray absorptiometry for osteoporosis diagnosis on lumbar spine and femoral neck. Osteoporos Int. 2019;30(2):391-402. doi: https://doi.org/10.1007/s00198-018-4686-3
27. Lalli P, Claudia Mautino, Chiara Busso, et al. Reproducibility and accuracy of the Radiofrequency Echographic Multi-spectrometry for femoral Mineral density estimation and discriminative power of the femoral fragility score in patients with primary and disuse-related osteoporosis. J Clin Med 2022; 11(13):3761. doi: https://doi.org/10.3390/jcm11133761
28. Picke AK, Campbell G, Napoli N, et al. Update on the Impact of Type 2 Diabetes Mellitus on Bone Metabolism and Material Properties. Endocr Connect. 2019;8(3):55–70. doi: https://doi.org/10.1530/EC-18-0456
29. Carla Caffarelli , Maria Dea Tomai Pitinca , Antonella Al Refaie. Ability of radiofrequency echographic multispectrometry to identify osteoporosis status in elderly women with type 2 diabetes. Aging clinical and experimental research. 2022;34(1):121-127. doi: https://doi.org/10.1007/s40520-021-01889-w
30. Fiorella Anna Lombardi, Paola Pisani, Francesco Conversano. REMS technology for the assessment of the effect of dmt2 on bone health. Annals of the Rheumatic Diseases. 2024;83:1399-1399. doi: https://doi.org/10.1136/annrheumdis-2024-eular.2241
31. Rolla M, Halupczok-Zyła J, Jawiarczyk-Przybyłowska A, et al. Bone densitometry by radiofrequency echographic multi-spectrometry (REMS) in acromegaly patients. Endokrynol. Pol. 2020;71:524–531. doi: https://doi.org/10.5603/EP.a2020.0056
32. Adami Giovanni, Brandi Maria Luisa, Caffarelli Carla. Bone health status evaluation in men by means of REMS technology. Aging clinical and experimental research. 2024;36(1):74. doi: https://doi.org/10.1007/s40520-024-02728-4
33. Adolfo Diez-Perez , Maria Luisa Brandi , Nasser Al-Daghri. Radiofrequency echographic multi-spectrometry for the invivo assessment of bone strength: state of the art-outcomes of an expert consensus meeting organized by the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Aging clinical and experimental research. 2019;31 (10): 1375-1389. doi: https://doi.org/10.1007/s40520-019-01294-4
Об авторах
А. С. ЖдановаРоссия
Жданова Анастасия Станиславовна, аспирант
117036, г. Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
М. А. Телегина
Россия
Телегина Мария Алексеевна, ординатор
Москва
ResearcherID: JMB-6130-2023
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. М. Артемова
Россия
Артемова Алла Михайловна, врач УЗИ-диагностики, заведующий кабинетом ультразвуковой диагностики
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна, д.м.н., профессор, доктор медицинских наук, заведующая отделением остеопороза и остеопатии отдела терапевтической эндокринологии, профессор кафедры эндокринологии института высшего и дополнительного профессионального образования
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Радиочастотная эхографическая мультиспектрометрия. Технология сканирования. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(992KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Жданова А.С., Телегина М.А., Артемова А.М., Белая Ж.Е. Радиочастотная эхографическая мультиспектрометрия (REMS): описание метода и перспективы его использования в клинической практике. Остеопороз и остеопатии. 2025;28(1):21-27. https://doi.org/10.14341/osteo13186
For citation:
Zhdanova A.S., Telegina M.А., Artemova A.M., Belaya Zh.E. Radiofrequency echographic multi spectrometry (REMS): description of the method and perspective for its usage in clinical practice. Osteoporosis and Bone Diseases. 2025;28(1):21-27. (In Russ.) https://doi.org/10.14341/osteo13186

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































