Перейти к:
Особенности метаболизма витамина D и регуляции кальций-фосфорного обмена у пациентов с хронической болезнью почек
https://doi.org/10.14341/osteo13197
Аннотация
Хроническая болезнь почек (ХБП) сопровождается значительными нарушениями минерального обмена и метаболизма витамина D, что приводит к развитию минеральных и костных нарушений (МКН-ХБП) и увеличению риска сердечно-сосудистых осложнений, переломов и смертности. В настоящей статье рассмотрены механизмы регуляции кальций-фосфорного обмена и метаболизма витамина D в норме и при ХБП, включая влияние паратиреоидного гормона (ПТГ), фактора роста фибробластов-23 (ФРФ-23) и α-Klotho. Обсуждаются современные подходы к лабораторной диагностике и целевые уровни параметров минерального обмена у пациентов с ХБП, а также перспективы применения новых биомаркеров, таких как соотношение 24,25(OH)2D/25(OH)D (VMR) и 1,24,25(OH)3D/1,25(OH)2D (1,25VMR). Представленный обзор подчеркивает необходимость дальнейших исследований для оптимизации диагностики и лечения минеральных нарушений у пациентов с ХБП.
Ключевые слова
Для цитирования:
Бондаренко А.С., Рожинская Л.Я., Жуков А.Ю., Белая Ж.Е., Мельниченко Г.А. Особенности метаболизма витамина D и регуляции кальций-фосфорного обмена у пациентов с хронической болезнью почек. Остеопороз и остеопатии. 2025;28(1):28-37. https://doi.org/10.14341/osteo13197
For citation:
Bondarenko A.S., Rozhinskaya L.Ya., Zhukov A.Yu., Belaya Zh.E., Melnichenko G.A. Vitamin D metabolism and regulation of calciumphosphorus homeostasis in patients with chronic kidney disease. Osteoporosis and Bone Diseases. 2025;28(1):28-37. (In Russ.) https://doi.org/10.14341/osteo13197
АКТУАЛЬНОСТЬ
Хроническая болезнь почек (ХБП) является наднозологическим понятием и определяется как нарушение структуры и/или функции почек, сохраняющееся не менее трех месяцев [1].
Частота встречаемости ХБП с 1990 по 2017 гг. увеличилась на 33% [2]. На текущий момент она затрагивает около 10% населения по всему миру, и ее распространенность сопоставима с такими социально значимыми заболеваниями, как гипертоническая болезнь, сахарный диабет (СД) и ожирение [1].
Прогрессирующее ухудшение почечной функции связано с развитием множества жизнеугрожающих осложнений, включая артериальную гипертензию, анемию, гиперкалиемию, метаболический ацидоз, а также минеральные и костные нарушения (МКН-ХБП).
МКН-ХБП представляют собой системную патологию и проявляются одним или комбинацией следующих признаков: нарушением минерального и костного обмена, развитием костных аномалий, кальцификацией сосудов или других мягких тканей [3]. Описанные изменения оказывают прямое воздействие на качество жизни пациентов, частоту госпитализаций, риск переломов и смерти [4–7]. Кроме того, данные крупного клинического исследования свидетельствуют, что МКН-ХБП ассоциируются с более высоким риском смертности (17,5%), чем анемия (11,3%) и нарушения режима диализа (5,1%) [8].
Неуклонный рост числа пациентов с ХБП и ассоциированные с этим риски делают данную проблему актуальной для дальнейшего изучения и разработки более эффективных методов коррекции нарушений минерального обмена, развивающихся на фоне данного состояния.
РЕГУЛЯЦИЯ КАЛЬЦИЙ-ФОСФОРНОГО ОБМЕНА И МЕТАБОЛИЗМА ВИТАМИНА D В ФИЗИОЛОГИЧЕСКИХ УСЛОВИЯХ
Основными факторами, обеспечивающими кальций-фосфорный гомеостаз, являются паратиреоидный гормон (ПТГ), фактор роста фибробластов-23 (ФРФ-23) и система витамина D, которые взаимодействуют между собой через множество петель обратной связи, рецепторов, ионных каналов и транспортеров.
ПТГ синтезируется околощитовидными железами (ОЩЖ), его секреция усиливается при снижении уровня кальция в крови и подавляется при его повышении [9]. Основными эффектами ПТГ являются мобилизация кальция из костной ткани, уменьшение его почечной экскреции, снижение реабсорбции фосфора в почках и, как следствие, стимулирование фосфатурии. Важным эффектом ПТГ, развивающимся в ответ на снижение кальциемии, является повышение активности 1α-гидроксилазы и увеличение концентрации активного метаболита витамина D (кальцитриола), что в конечном счете ведет к увеличению кишечной абсорбции кальция и фосфора [10].
ФРФ-23 секретируется клетками костной ткани, преимущественно остеоцитами. Основным стимулом к увеличению продукции ФРФ-23 является повышение концентрации фосфора и активного метаболита витамина D в крови. ФРФ-23 увеличивает выведение фосфатов с мочой, подавляет секрецию ПТГ и продукцию кальцитриола, а также способствует повышению функциональной активности 24-гидроксилазы и интенсификации катаболизма витамина D. Описанные физиологические функции ФРФ-23 опосредуются активацией бинарных рецепторных комплексов рецептора ФРФ-23 и α-Klotho на поверхности клеток [11].
Витамин D представлен двумя формами — D2 (эргокальциферол) и D3 (колекальциферол). D3 синтезируется в коже человека из 7-дегидрохолестерола (провитамина D3, pro-D3), в два этапа без участия ферментов (с образованием pre-D3 как промежуточного звена метаболизма), а также дополнительно поступает с продуктами питания животного происхождения [12][13]. При длительном воздействии ультрафиолетовых лучей типа В (UVB) на кожу часть pre-D3 претерпевает дальнейшие фотохимические изменения, приводящие к образованию люмистерола3 и тахистерола3 [14]. D2 в свою очередь синтезируется только в грибах и дрожжах под воздействием UVB на эргостерол (провитамин D2, pro-D2) [15]. Таким образом, единственным источником D2 в организме человека являются продукты питания. При этом обе формы витамина D обладают схожей биологической активностью, метаболизируются и реализуют свои функции посредством единых механизмов [16] .
Витамин D является жирорастворимым и всасывается в энтероцитах в результате как пассивного, так и активного процессов с помощью переносчиков холестерина [17]. Исследования демонстрируют накопление витамина D во многих тканях, при этом жировая ткань и скелетные мышцы являются основными локализациями его хранения в организме человека [18][19].
Дальнейший метаболизм витамина D включает три основных этапа, обеспечивающихся оксидазами со смешанной функцией цитохрома P450 (CYP) — гидроксилирования в положениях С25, С1α и С24. В результате 25-гидроксилирования образуется кальцидиол (25(OH)D), являющийся основным циркулирующим метаболитом с периодом полужизни 2–3 недели и традиционно использующийся для оценки статуса витамина D [20]. Этот процесс обеспечивается рядом ферментов, основным из которых является CYP2R1 (25-гидроксилаза), экспрессирующийся преимущественно в печени (микросомальная фракция CYP гепатоцитов) и семенниках [21] и гидроксилирующий обе формы витамина D, имея большую аффинность к D3 [22]. Уровень 25(OH)D, определяемый лабораторно, используется для оценки статуса обеспеченности организма витамином D, т.к. отражает его запасы, доступные для использования [23]. В результате дальнейшего 1α-гидроксилирования 25(OH)D образуется кальцитриол (1,25(OH)2D) — метаболит с периодом полужизни 5–10 часов, который в наибольшей степени реализует биологические функции витамина D и традиционно называется «активным метаболитом витамина D» [24], хотя его концентрация в крови примерно в тысячу раз ниже 25(OH)D (порядок измерения пг/мл и нг/мл соответственно) [16]. Этот процесс обеспечивается ферментом CYP27B1 (1α-гидроксилазой), значительная часть которого экспрессируется в проксимальных извитых канальцах нефронов [25][26]. Ключевую роль в регуляции доступности субстрата для этого фермента играет мегалин, являющийся мультилигандным рецептором. Мегалин обеспечивает активный эндоцитоз фильтруемого 25-гидроксивитамина D, связанного с белками-переносчиками (витамин-D-связывающим белком (VDBP) и альбумином). После эндоцитоза 25-гидроксивитамин D может либо транспортироваться к месту 1α-гидроксилирования в митохондриях, где происходит его преобразование в кальцитриол, либо возвращаться в кровоток, поддерживая уровень 25-гидроксивитамина D в циркуляции [27][28]. Долгое время почечная локализация CYP27B1 считалась единственным источником эндогенного 1,25(ОН)2D, однако в последующих исследованиях было выяснено, что фермент широко экспрессируется в организме, в том числе в макрофагах [29]. Локальная продукция CYP27B1 была также продемонстрирована во многих других тканях; в большинстве случаев данные исследований указывают на ее аутокринную и паракринную функции и соответствующую особую регуляцию [30]. Дальнейшему гидроксилированию в положении С24 подвергаются и 25(OH)D, и 1,25(OH)2D, в результате чего образуются 24,25(OH)2D и 1,24,25(OH)3D соответственно. Этот процесс осуществляется митохондриальным ферментом CYP24A1 (24-гидроксилазой), присутствие которого выявлено в большинстве тканей, в которых экспрессируются другие элементы системы витамина D [31]. Параллельным метаболическим путем является гидроксилирование обоих метаболитов в положении С23, осуществляемое тем же ферментом [32]. Дальнейшие многоступенчатые реакции с многократным последовательным гидроксилированием осуществляются также CYP24A1. Конечными продуктами обоих путей метаболизма являются кальцитроевая кислота и 1,25(OH)2D-26,23-лактон, выводимые c желчными кислотами [33]. Кальцитроевая кислота не обладает биологической активностью, а роль других промежуточных и конечных метаболитов остается предметом дискуссий, однако общепризнано, что она значимо ниже, чем у 1,25(OH)2D [34]. Таким образом, основной функцией CYP24A1 является инактивация витамина D. Активность фермента регулируется реципрокно CYP27B1, теми же факторами [20].
Альтернативным метаболическим путем является С3 эпимеризация, описанная для большинства метаболитов витамина D. Фермент, ответственный за этот процесс, не был определен [35]. С3 эпимеризация в свою очередь не препятствует действию CYP27B1 и CYP24A1. Было продемонстрировано, что большинство С3 эпимерных метаболитов имеют меньшую биологическую активность по сравнению с аналогами [36], однако 3-epi-1,25(OH)2D характеризуется даже большей метаболической стабильностью по сравнению с 1,25(OH)2D [20] и сопоставимой способностью подавлять избыточную секрецию ПТГ [37]. С3 эпимеры вносят значимый вклад в общую концентрацию соответствующих метаболитов, особенно у новорожденных и детей раннего возраста, у которых могут превышать половину от нее [38]. Тем не менее физиологическая роль этого резервного пути еще требует выяснения, а его регуляция остается не вполне ясной, однако было показано, что пациенты с супрессированным ПТГ при гиперкальциемии имели более высокие концентрации эпимеров [39]. Представленные пути метаболизма являются основными, но далеко не исчерпывающими. Всего описано более 50 различных метаболитов витамина D, биологическая роль большинства из которых остается неизвестной [40]. Упрощенная схема метаболизма витамина D представлена на рисунке 1.

Рисунок 1. Упрощенная схема метаболизма витамина D в физиологических условиях.
hv — реакция фотохимической изомеризации; ∆T — реакция термохимической изомеризации.
В настоящее время высокоэффективная жидкостная хроматография с тандемным масс-спектрометрическим детектированием (ВЭЖХ-МС/МС) считается золотым стандартом определения метаболитов витамина D. Это обусловлено высокими чувствительностью, воспроизводимостью и точностью метода, а также способностью отделять концентрации различных метаболитов друг от друга и определять их одновременно [41].
Метаболиты витамина D циркулируют в кровотоке преимущественно в форме, связанной специфическим витамин D-связывающим белком (vitamin D binding protein, VDBP), который синтезируется в печени. Только 0,03% 25(OH)D и 0,4% 1,25(OH)2D циркулируют в свободном виде [42]. В то же время именно им отводится ключевая роль в обеспечении биологической функции витамина D в некоторых тканях [43]. В настоящее время биологическая роль VDBP представляется как депо витамина D, предотвращающее его истинный дефицит при низком поступлении, а также в качестве регулятора доступности витамина D в некоторых тканях [42][44].
Витамин D реализует свои биологические эффекты преимущественно за счет связывания со специфическим рецептором витамина D (vitamin D receptor, VDR), который относится к суперсемейству ядерных рецепторов наряду с рецепторами других стероидных гормонов и является транскрипционным фактором множества генов.
К «классическим» эффектам витамина D традиционно относят влияние на всасывание кальция в кишечнике, ОЩЖ и костную ткань. Механизм влияния 1,25(OH)2D на обмен фосфора понятен в меньшей степени, однако известно, что витамин D способствует эффективной абсорбции фосфатов в кишечнике [45], а также индуцирует экспрессию ФРФ-23 остеоцитами [46]. 1,25(OH)2D является основным регулятором двух наиболее распространенных белков костного матрикса, подавляя синтез коллагена I типа и индуцируя синтез остеокальцина [16]. При этом предполагается, что влияние витамина D на костную ткань зависит от баланса кальция. При положительном балансе, то есть абсорбции достаточного количества кальция, значимость его влияния остается неясной. При отрицательном балансе кальция повышенные уровни циркулирующего ПТГ и 1,25(OH)2D стимулируют выработку RANKL остеобластами, что усиливает костную резорбцию остеокластами. Более того, высокие уровни 1,25(OH)2D индуцируют экспрессию ингибиторов минерализации в остеобластах и остеоцитах и снижают минерализацию костного матрикса [47]. Некоторые из биологических эффектов 1,25(OH)2D развиваются слишком быстро, чтобы их можно было связать с транскрипционными механизмами, в связи с чем предположен негеномный механизм действия. Так, наблюдаются быстрое увеличение концентрации внутриклеточного кальция, активация фосфолипазы C и открытие кальциевых каналов в некоторых типах клеток в течение нескольких минут воздействия 1,25(OH)2D [16]. Также негеномный механизм действия был продемонстрирован в отношении транскальтахии — быстрой стимуляции кишечной абсорбции кальция [48] — и воздействия на хондроциты пластинки роста и кератиноциты кожи [20]. Предполагается, что он может реализовываться за счет VDR иной конфигурации и мембранно-ассоциированного стероидсвязывающего белка быстрого ответа (membrane-associated rapid response steroid binding protein, MARRS), которые расположены на мембране клеток и являются как метаботропными, так и ионотропными [49]. Физиологическая значимость негеномного действия метаболитов витамина D остается предметом дискуссий.
ОСОБЕННОСТИ РЕГУЛЯЦИИ КАЛЬЦИЙ-ФОСФОРНОГО ОБМЕНА И МЕТАБОЛИЗМА ВИТАМИНА D ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК
В основе патогенеза МКН-ХБП лежат сложные взаимодействия между факторами, участвующими в регуляции кальций-фосфорного обмена и метаболизма витамина D. Изменения, характерные для МКН-ХБП, начинают развиваться уже на ранних стадиях заболевания, но клинически становятся заметными только при снижении скорости клубочковой фильтрации (СКФ) ниже 60 мл/мин/1,73 м², нарастая по мере прогрессирования нарушения почечной функции [50][51]. Основные лабораторные изменения, характерные для МКН-ХБП, в зависимости от стадии нарушения почечной функции схематически представлены на рисунке 2.
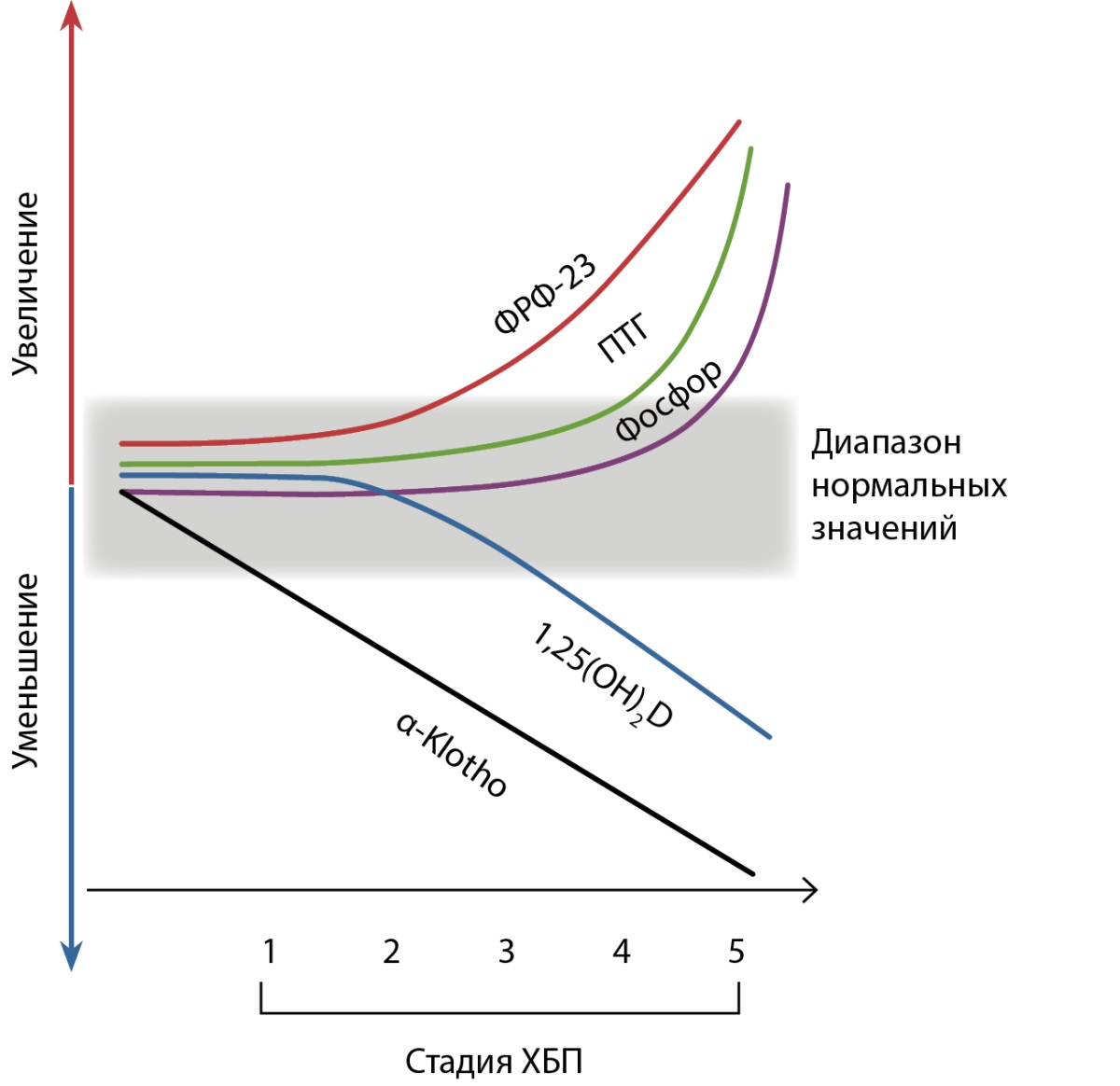
Риcунок 2. Основные лабораторные изменения, характерные для МКН-ХБП, в зависимости от стадии нарушения почечной функции.
Адаптировано из [52].
ПТГ — паратиреоидный гормон; ФРФ-23 — фактор роста фибробластов-23; ХБП — хроническая болезнь почек.
Снижение числа функционирующих нефронов, сопровождающее ХБП, во-первых, приводит к снижению экскреции фосфора с мочой, а во-вторых, к снижению активности 1α-гидроксилазы и, соответственно, продукции активного метаболита витамина D — 1,25(ОН)2D [53].
Вследствие ретенции фосфора в организме, как было показано в исследовании Т. Isakova и соавт., в первую очередь активируется синтез ФРФ-23 [54]. Повышенный уровень ФРФ-23, с одной стороны, оказывает необходимый фосфатурический эффект, что способствует поддержанию нормофосфатемии на ранних стадиях заболевания, а с другой — усугубляет дефицит кальцитриола, ингибируя экспрессию 1-α-гидроксилазы.
Нарушение продукции 1,25(ОН)2D также может объясняться ограничением доставки 25(ОН)D к месту его активации в почках вследствие снижения СКФ [55] и экспрессии мегалина в условиях дефицита кальцитриола [28]. Этот процесс усугубляется протеинурией, характерной для ХБП, которая способствует потере 25(ОН)D, связанного с VDBP, с мочой [56]. Кроме того, существуют данные о том, что в условиях уремической интоксикации нарушается процесс 25-гидроксилирования в печени, что вносит дополнительный вклад в развитие дефицита 25(ОН)D [57].
Дополнительно снижать активность 1α-гидроксилазы могут накапливающиеся по мере прогрессирования почечной недостаточности уремические токсины, что было показано в экспериментальной работе C.H. Hsu и S. Patel [58].
Снижение уровня кальцитриола в крови сопровождается уменьшением всасывания кальция в кишечнике, что приводит к развитию гипокальциемии. В сочетании с гиперфосфатемией эти изменения вызывают компенсаторное повышение уровня ПТГ. Важно отметить, что утрата экспрессии мегалина в почках ослабляет фосфатурическое действие ПТГ, поскольку мегалин также участвует в работе натрий-фосфатного котранспортера [59], а снижение синтеза кальцитриола способствует снижению чувствительности VDR и уменьшению экспрессии CaSR (кальций-чувствительных рецепторов) на клетках ОЩЖ, что также усиливает продукцию ПТГ и приводит к гиперплазии ОЩЖ [60].
Дополнительный вклад в развитие МКН-ХБП вносит снижение экспрессии α-Klotho в ОЩЖ и почках при длительном течении заболевания, что объясняет их резистентность к действию ФРФ-23 на поздних стадиях ХБП [61].
Несмотря на снижение продукции кальцитриола, даже на терминальных стадиях заболевания уровень 1,25(ОН)2D не снижается до нулевых значений, что объясняется его внепочечным синтезом. Так, в исследовании, проведенном на пациентах, перенесших двустороннюю нефрэктомию, были продемонстрированы низко-нормальные уровни 1,25(ОН)2D. Интересно, что у пациентов в указанном исследовании уровень кальцитриола не коррелирует ни с уровнем ПТГ, ни с ФРФ-23, что свидетельствует о том, что экстраренальная активность CYP27B1, вероятно, больше зависит от доступности субстрата, чем от гормональной регуляции [62].
Если роль динамики ПТГ, ФРФ-23, 25(ОН)D, 1,25(ОН)2D и широко обсуждается в литературе, то значение и патофизиология изменений концентраций других метаболитов витамина D менее изучена. Согласно классическим представлениям, прогрессирующее повышение уровня ФРФ-23 при хронической болезни почек способствует снижению концентраций 25(OH)D и 1,25(OH)2D за счет стимуляции 24-гидроксилазы и усиленного катаболизма этих метаболитов. Однако результаты клинических и экспериментальных исследований не подтверждают данную гипотезу. Так, в исследовании Bing Dai и соавт. было показано, что уровни 24,25(OH)2D в сыворотке крови, вопреки ожиданиям, снижены как у мышей с моделью ХБП, так и у пациентов с данным заболеванием. При этом снижение 24,25(OH)2D у пациентов коррелирует с низкими концентрациями 25(OH)D, а также повышенными уровнями ФРФ-23 и ПТГ [63]. Кроме того, по данным работы Ian H. de Boer и соавт., снижение СКФ было ассоциировано с угнетением катаболизма витамина D, что подтверждается уменьшением циркулирующей концентрации 24,25(OH)2D3 [64]. Сходные данные получены в работе Simon Hsu и соавт., где также отмечено снижение VMR (vitamin D metabolite ratio, соотношение 24,25(OH)2D3 к 25(OH)D3) [65]. Данные по снижению VMR у пациентов с ХБП также были описаны в работе Mandy E. Turner и соавт. Кроме того, в данной работе впервые было оценено соотношение 1,24,25(OH)3D3/1,25(OH)2D3 (1,25VMR), которое увеличивалось по мере снижения СКФ у пациентов с ХБП и у крыс с индуцированным и прогрессирующим нарушением фильтрационной функции почек [66].
АКТУАЛЬНЫЕ ПОДХОДЫ К ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ НАРУШЕНИЙ КАЛЬЦИЙ-ФОСФОРНОГО ОБМЕНА И ЕГО РЕГУЛЯЦИИ У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ БОЛЕЗНЬЮ ПОЧЕК
В соответствии с существующими российскими и зарубежными клиническими рекомендациями скрининг на нарушения минерального обмена, включающий определение концентраций кальция, фосфора, ПТГ и щелочной фосфатазы, рекомендован всем пациентам со снижением СКФ ниже 60 мл/мин/1,73 м² [1][67].
Хотя контроль уровня 25(ОН)D считается важным компонентом профилактики и лечения нарушений минерального обмена при ХБП, имеющиеся результаты исследований остаются противоречивыми. Так, согласно данным метаанализа 1 281 исследования, более высокие уровни 25(OH)D в сыворотке крови ассоциировались с более низким риском общей смертности у пациентов с ХБП: увеличение уровня 25(OH)D на каждые 10 нг/мл сопровождалось снижением риска общей смертности на 21%, а наиболее низкий риск общей смертности наблюдался при уровне 25(OH)D около 25–30 нг/мл [68]. Результаты другого метаанализа, включавшего 128 работ и 11 270 пациентов, показали отсутствие значимого влияния терапии витамином D на общую смертность, а также неопределенное влияние на частоту переломов и сердечно-сосудистую смертность [69].
Существующие на данный момент клинические рекомендации предлагают оценивать и корректировать уровень 25(OH)D с использованием стандартных для общей популяции режимов [1][67], при этом целевыми уровнями 25(OH)D для популяции считают 30–60 нг/мл [70]. Однако до сих пор непонятно, применимы ли данные рекомендации к пациентам с ХБП. Так, например, результаты кросс-секционного исследования J. Ennis и соавт. с включением 14 289 пациентов показали, что подавление ПТГ оптимально только при достижении уровня 25(OH)D 42–48 нг/мл, что в целом выше целевых показателей для общей популяции [71].
Хотя наиболее широко используемым методом оценки статуса витамина D у пациентов данной когорты является определение уровня 25(OH)D, его надежность остается на текущий момент предметом дискуссий [72][73]. В последние годы предложены альтернативные подходы к оценке статуса витамина D, включая определение уровня 24,25(OH)2D в сыворотке крови и расчет соотношения 24,25(OH)2D/25(OH)D. Эти показатели рассматриваются как перспективные биомаркеры, предоставляющие более точную информацию о состоянии метаболизма витамина D [23]. Так, в исследовании Seattle Kidney Study было показано, что концентрация 24,25(OH)2D в сыворотке ниже медианного значения (2,4 нг/мл) ассоциировалась со сниженной СКФ и повышенным риском смертности. Более того, отрицательная корреляция уровня 24,25(OH)2D с ПТГ была более значимой по сравнению с аналогичными корреляциями для 25(OH)D и 1,25(OH)2D [74]. Сходные данные были получены в исследовании Seunghye Lee и соавт., где концентрация 25(OH)D показала слабую корреляцию с расчетной СКФ, тогда как значения 24,25(OH)2D и VMR имели значимую связь как с СКФ, так и с уровнем ПТГ [75].
Интересно отметить, что действующие клинические рекомендации KDIGO (Kidney Disease Improving Global Outcomes) не рекомендуют рутинное измерение уровня 1,25(OH)2D, т.к. период полувыведения этого метаболита короткий, существуют сложности со стандартизацией методики определения, полученные значения могут отражать ятрогенные изменения при экзогенном введении кальцитриола или его аналогов [67]. Кроме того, на данный момент отсутствуют данные, подтверждающие полезность данного измерения для выбора терапии или прогнозирования исходов. Однако, согласно результатам исследования A. Galassi и соавт., 1,25(OH)2D заслуживает внимания как маркер состояния канальцев почек и как чувствительный предиктор ухудшения почечной функции в краткосрочной перспективе у пациентов молодого и среднего возраста с ХБП 3 стадии. Более того, отношение 1,25(OH)2D/ПТГ может служить сложным биомаркером, отражающим резерв канальцев и эндокринный ответ на переход от адаптивного к дезадаптивному состоянию при нарушениях минерального обмена у пациентов с нарушением почечной функции [76].
На данный момент неизвестно, какой уровень ПТГ можно считать оптимальным у пациентов на преддиализных стадиях ХБП. На сегодняшний день недостаточно рандомизированных контролируемых исследований, подтверждающих, что достижение конкретного уровня ПТГ непосредственно улучшает клинические исходы при ХБП. Более того, интервенционные исследования, способные установить причинно-следственную связь между биохимическими показателями и наблюдаемыми результатами, также не проводились. Данные существующих исследований остаются неоднозначными. Так, ряд работ выявляет U-образную зависимость, при которой как низкие, так и высокие уровни ПТГ ассоциируются с увеличением риска неблагоприятных исходов. Современные международные данные, в том числе анализ DOPPS, чаще свидетельствуют о повышении относительного риска общей смертности, но не сердечно-сосудистой, при уровнях ПТГ свыше 600 пг/мл [77]. В то же время в итальянском исследовании FARO уровень ПТГ≤150 пг/мл был связан с улучшением выживаемости пациентов [78]. Хотя результаты ряда других работ наоборот указывают на связь низких уровней ПТГ с ростом риска смертности [79]. При этом результаты крупных исследований, таких как PRIMO и OPERA, показали, что снижение уровня ПТГ с использованием аналогов витамина D у пациентов с ХБП стадий 3–5 не оказало значимого влияния на основные клинические исходы [80][81].
По мнению рабочей группы KDIGO, длительное и непрерывное увеличение уровня ПТГ, вероятно, свидетельствует о дезадаптивной реакции организма и требует назначения терапии [67]. В соответствии с рекомендациями российского общества нефрологов, у пациентов с ХБП стадий 3–5 целевыми значениями циркулирующего ПТГ предлагается считать показатели, находящиеся в пределах двукратного превышения верхней границы референсного интервала (≈130 пг/мл) [1].
Что касается уровня ПТГ у диализных пациентов, российские клинические рекомендации предлагают следующую стратегию. У пациентов с ХБП стадии 5Д при стойком превышении уровня ПТГ в крови в четыре раза выше верхней границы нормы (≈ >260 пг/мл) рекомендуется фармакологическое лечение, направленное на достижение целевых концентраций ПТГ в пределах 2–4-кратного превышения верхней границы референсного интервала (≈ 130–260 пг/мл) [1]. Рекомендации KDIGO, в свою очередь, предлагают поддерживать уровень ПТГ у таких пациентов в диапазоне примерно от 2 до 9 верхних границ нормы. Кроме того, они подчеркивают, что значительные изменения уровня ПТГ в любом направлении в пределах этого диапазона должны служить основанием для начала или изменения терапии, чтобы избежать дальнейшего выхода за пределы указанного диапазона [67].
Как российские клинические рекомендации, так и рекомендации KDIGO, сходятся во мнении, что уровни кальция и фосфора у пациентов с ХБП должны поддерживаться в пределах референсных значений, соответствующих общей популяции. В российских клинических рекомендациях также подчеркивается, что коррекция бессимптомной гипокальциемии не является необходимой [1][67].
Особое внимание уделяется коррекции гиперфосфатемии, так как накопленные эпидемиологические данные подтверждают ее значимую роль в развитии вторичного гиперпаратиреоза, сосудистой кальцификации, прогрессировании нарушения почечной функции, а также повышении риска общей и сердечно-сосудистой смертности [82–84].
Доказательства, подтверждающие связь уровня кальция с неблагоприятными исходами, остаются ограниченными. Тем не менее несколько исследований указывают на ассоциацию между низким уровнем кальция в сыворотке крови и ухудшением клинических показателей у пациентов с ХБП стадий 3–4. Например, в работе L.-M. Lim и соавт. низкий уровень кальция (<2,25 ммоль/л) ассоциировался с повышенным риском необходимости в заместительной почечной терапии и ускоренной прогрессией почечной недостаточности по сравнению с высоким уровнем кальция (>2,45 ммоль/л) [85]. В исследовании C.J. Janmaat и соавт. было выявлено, что увеличение уровня кальция на 0,25 ммоль/л коррелировало с замедлением снижения СКФ, причем этот эффект был наиболее выражен на поздних стадиях ХБП [86]. Гипокальциемия у пациентов на диализе также связана с повышенным риском летального исхода, что, вероятно, обусловлено гипотензией, застойной сердечной недостаточностью и аритмиями, приводящими к внезапной сердечной смерти [87–89]. Ряд наблюдательных исследований показывает, что у пациентов на гемодиализе гиперкальциемия тесно связана с риском смертности от сердечно-сосудистых и инфекционных заболеваний, а также с общей смертностью [90–92]. Повышенные уровни кальция способствуют ускоренному образованию и созреванию кальцифицированных частиц, что ведет к прогрессированию сосудистой кальцификации, атеросклероза и артериосклероза [93][94]. Также гиперкальциемия может вызывать кальцификацию проводящей системы сердца, что, в свою очередь, увеличивает риск внезапной смерти, связанной с брадиаритмиями [95].
ЗАКЛЮЧЕНИЕ
Несмотря на то, что вопросы диагностики и лечения нарушений минерального обмена у пациентов с ХБП изучаются уже давно, определена значимость поддержания оптимальных уровней кальция и фосфора, сохраняются противоречия и дискуссии по оптимальным уровням ПТГ на преддиализных и диализных стадиях, необходимости контроля ФРФ-23 и α-Klotho. Еще в меньшей степени изучена роль дефицита витамина D, и в особенности его метаболитов, в прогрессировании ХБП и влиянии на клинические исходы. Известно, что 1α-гидроксилированные метаболиты циркулируют в концентрации примерно в 1000 раз меньшей, чем их не-1α-гидроксилированные аналоги. Оптимальным методом определения метаболитов витамина D является метод ВЭЖХ-МС/МС. Особое внимание в последние годы уделяется метаболитам 24,25(OH)2D и 1,24,25(OH)3D, их соотношениям с 25(ОН)D (VMR) и с 1,25(ОН)2D (1,25VMR) соответственно, что является важной областью будущих исследований перед использованием их в качестве потенциального диагностического инструмента. Разработка профиля витамина D, который включает VMR и оценку реакции на добавки витамина D, с течением времени может лучше определить адекватность их применения при ХБП и необходимость и время включения в план коррекции вторичного гиперпаратиреоза активных метаболитов витамина D или их аналогов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Государственное задание №НИОКТР 124020700097-8 при поддержке Министерства здравоохранения Российской Федерации.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы внесли значимый вклад в проведение аналитической работы, написание и подготовку научного обзора, прочли и одобрили финальную версию статьи, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Клинические рекомендации Министерства здравоохранения Российской Федерации «Хроническая болезнь почек». — 2024. — Текст: электронный // Рубрикатор клинических рекомендаций: сайт. — URL: https://cr.minzdrav.gov.ru/viewcr/469_3 (дата обращения: 10.02.2025).
2. Francis A, Harhay MN, Ong ACM, et al. Chronic kidney disease and the global public health agenda: an international consensus. Nat Rev Nephrol. 2024;20(7):473-485. doi: https://doi.org/10.1038/s41581-024-00820-6
3. Moe S, Drüeke T, Cunningham J, et al. Definition, evaluation, and classification of renal osteodystrophy: A position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int. 2006;69(11):1945-1953. doi: https://doi.org/10.1038/sj.ki.5000414
4. Abdalbary M, Sobh M, Elnagar S, et al. Management of osteoporosis in patients with chronic kidney disease. Osteoporosis International. 2022;33(11):2259-2274. doi: https://doi.org/10.1007/s00198-022-06462-3
5. Yamada S, Nakano T. Role of Chronic Kidney Disease (CKD)–Mineral and Bone Disorder (MBD) in the Pathogenesis of Cardiovascular Disease in CKD. J Atheroscler Thromb. 2023;30(8):RV22006. doi: https://doi.org/10.5551/jat.RV22006
6. Luo L, Chen Q. Effect of CKD–MBD phenotype on health-related quality of life in patients receiving maintenance hemodialysis: A cross-sectional study. Journal of International Medical Research. 2020;48(2). doi: https://doi.org/10.1177/0300060519895844
7. Magagnoli L, Cozzolino M, Caskey FJ, et al. Association between CKD-MBD and mortality in older patients with advanced CKD—results from the EQUAL study. Nephrology Dialysis Transplantation. 2023;38(11):2562-2575. doi: https://doi.org/10.1093/ndt/gfad100
8. Block GA, Klassen PS, Lazarus JM, Ofsthun N, Lowrie EG, Chertow GM. Mineral Metabolism, Mortality, and Morbidity in Maintenance Hemodialysis. Journal of the American Society of Nephrology. 2004;15(8):2208-2218. doi: https://doi.org/10.1097/01.ASN.0000133041.27682.A2
9. Raue F, Haag C, Schulze E, Frank-Raue K. The Role of the Extracellullar Calcium-Sensing Receptor in Health and Disease. Experimental and Clinical Endocrinology & Diabetes. 2006;114(08):397-405. doi: https://doi.org/10.1055/s-2006-924315
10. Murray SL, Wolf M. Calcium and Phosphate Disorders: Core Curriculum 2024. American Journal of Kidney Diseases. 2024;83(2):241-256. doi: https://doi.org/10.1053/j.ajkd.2023.04.017
11. Quarles LD. Fibroblast growth factor 23 and α-Klotho co-dependent and independent functions. Curr Opin Nephrol Hypertens. 2019;28(1):16-25. doi: https://doi.org/10.1097/MNH.0000000000000467
12. Prabhu A V, Luu W, Li D, Sharpe LJ, Brown AJ. DHCR7: A vital enzyme switch between cholesterol and vitamin D production. Prog Lipid Res. 2016;64:138-151. doi: https://doi.org/10.1016/j.plipres.2016.09.003
13. Prabhu A V, Luu W, Sharpe LJ, Brown AJ. Cholesterol-mediated Degradation of 7-Dehydrocholesterol Reductase Switches the Balance from Cholesterol to Vitamin D Synthesis. Journal of Biological Chemistry. 2016;291(16):8363-8373. doi: https://doi.org/10.1074/jbc.M115.699546
14. Wacker M, Holick MF. Sunlight and Vitamin D. Dermatoendocrinol. 2013;5(1):51-108. doi: https://doi.org/10.4161/derm.24494
15. Jäpelt RB, Jakobsen J. Vitamin D in plants: a review of occurrence, analysis, and biosynthesis. Front Plant Sci. 2013;4. doi: https://doi.org/10.3389/fpls.2013.00136
16. Melmed S, Polonsky KS, Larsen PR, Kronenberg HM, editors. Williams Textbook of Endocrinology. 15th ed. Philadelphia, PA: Elsevier; 2025.
17. Borel P, Caillaud D, Cano NJ. Vitamin D Bioavailability: State of the Art. Crit Rev Food Sci Nutr. 2015;55(9):1193-1205. doi: https://doi.org/10.1080/10408398.2012.688897
18. Rosenstreich SJ, Rich C, Volwiler W. Deposition in and release of vitamin D3 from body fat: evidence for a storage site in the rat. Journal of Clinical Investigation. 1971;50(3):679-687. doi: https://doi.org/10.1172/JCI106538
19. Abboud M, Puglisi DA, Davies BN, et al. Evidence for a Specific Uptake and Retention Mechanism for 25-Hydroxyvitamin D (25OHD) in Skeletal Muscle Cells. Endocrinology. 2013;154(9):3022-3030. doi: https://doi.org/10.1210/en.2012-2245
20. Bikle DD. Vitamin D Metabolism, Mechanism of Action, and Clinical Applications. Chem Biol. 2014;21(3):319-329. doi: https://doi.org/10.1016/j.chembiol.2013.12.016
21. Cheng JB, Motola DL, Mangelsdorf DJ, Russell DW. De-orphanization of Cytochrome P450 2R1. Journal of Biological Chemistry. 2003;278(39):38084-38093. doi: https://doi.org/10.1074/jbc.M307028200
22. Strushkevich N, Usanov SA, Plotnikov AN, Jones G, Park HW. Structural Analysis of CYP2R1 in Complex with Vitamin D3. J Mol Biol. 2008;380(1):95-106. doi: https://doi.org/10.1016/j.jmb.2008.03.065
23. Alonso N, Zelzer S, Eibinger G, Herrmann M. Vitamin D Metabolites: Analytical Challenges and Clinical Relevance. Calcif Tissue Int. 2022;112(2):158-177. doi: https://doi.org/10.1007/s00223-022-00961-5
24. Bailie GR, Johnson CA. Comparative Review of the Pharmacokinetics of Vitamin D Analogues. Semin Dial. 2002;15(5):352-357. doi: https://doi.org/10.1046/j.1525-139X.2002.00086.x
25. Takeyama Kichi, Kitanaka S, Sato T, Kobori M, Yanagisawa J, Kato S. 25-Hydroxyvitamin D 3 1α-Hydroxylase and Vitamin D Synthesis. Science (1979). 1997;277(5333):1827-1830. doi: https://doi.org/10.1126/science.277.5333.1827
26. Fraser DR, Kodicek E. Unique Biosynthesis by Kidney of a Biologically Active Vitamin D Metabolite. Nature. 1970;228(5273):764-766. doi: https://doi.org/10.1038/228764a0
27. Nykjaer A, Dragun D, Walther D, et al. An Endocytic Pathway Essential for Renal Uptake and Activation of the Steroid 25-(OH) Vitamin D3. Cell. 1999;96(4):507-515. doi: https://doi.org/10.1016/S0092-8674(00)80655-8
28. Liu, Yu, Carling, et al. Regulation of gp330/megalin expression by vitamins A and D. Eur J Clin Invest. 1998;28(2):100-107. doi: https://doi.org/10.1046/j.1365-2362.1998.00253.x
29. Adams JS, Sharma OP, Gacad MA, Singer FR. Metabolism of 25-hydroxyvitamin D3 by cultured pulmonary alveolar macrophages in sarcoidosis. Journal of Clinical Investigation. 1983;72(5):1856-1860. doi: https://doi.org/10.1172/JCI111147
30. Bikle DD, Patzek S, Wang Y. Physiologic and pathophysiologic roles of extra renal CYP27b1: Case report and review. Bone Rep. 2018;8:255-267. doi: https://doi.org/10.1016/j.bonr.2018.02.004
31. Jones G, Prosser DE, Kaufmann M. 25-Hydroxyvitamin D-24-hydroxylase (CYP24A1): Its important role in the degradation of vitamin D. Arch Biochem Biophys. 2012;523(1):9-18. doi: https://doi.org/10.1016/j.abb.2011.11.003
32. Prosser DE, Kaufmann M, O’Leary B, Byford V, Jones G. Single A326G mutation converts human CYP24A1 from 25-OH-D 3 -24-hydroxylase into -23-hydroxylase, generating 1α,25-(OH) 2 D 3 -26,23-lactone. Proceedings of the National Academy of Sciences. 2007;104(31):12673-12678. doi: https://doi.org/10.1073/pnas.0702093104
33. Cappellani D, Brancatella A, Kaufmann M, et al. Hereditary Hypercalcemia Caused by a Homozygous Pathogenic Variant in the CYP24A1 Gene: A Case Report and Review of the Literature. Case Rep Endocrinol. 2019;2019:1-7. doi: https://doi.org/10.1155/2019/4982621
34. Jones G, Kaufmann M. Diagnostic Aspects of Vitamin D: Clinical Utility of Vitamin D Metabolite Profiling. JBMR Plus. 2021;5(12). doi: https://doi.org/10.1002/jbm4.10581
35. Molnár F, Sigüeiro R, Sato Y, et al. 1α,25(OH)2-3-Epi-Vitamin D3, a Natural Physiological Metabolite of Vitamin D3: Its Synthesis, Biological Activity and Crystal Structure with Its Receptor. PLoS One. 2011;6(3):e18124. doi: https://doi.org/10.1371/journal.pone.0018124
36. Kamao M, Tatematsu S, Hatakeyama S, et al. C-3 Epimerization of Vitamin D3 Metabolites and Further Metabolism of C-3 Epimers. Journal of Biological Chemistry. 2004;279(16):15897-15907. doi: https://doi.org/10.1074/jbc.M311473200
37. Astecker N, Satyanarayana Reddy G, Herzig G, Vorisek G, Schuster I. 1α,25-Dihydroxy-3-epi-vitamin D3 a physiological metabolite of 1α,25-dihydroxyvitamin D3: Its production and metabolism in primary human keratinocytes. Mol Cell Endocrinol. 2000;170(1-2):91-101. doi: https://doi.org/10.1016/S0303-7207(00)00330-0
38. Singh RJ, Taylor RL, Reddy GS, Grebe SKG. C-3 Epimers Can Account for a Significant Proportion of Total Circulating 25-Hydroxyvitamin D in Infants, Complicating Accurate Measurement and Interpretation of Vitamin D Status. J Clin Endocrinol Metab. 2006;91(8):3055-3061. doi: https://doi.org/10.1210/jc.2006-0710
39. Granado-Lorencio F, Blanco-Navarro I, Pérez-Sacristán B, Donoso-Navarro E, Silvestre-Mardomingo R. Serum levels of 3-Epi-25-OH-D3 during Hypervitaminosis D in Clinical Practice. J Clin Endocrinol Metab. 2012;97(12):E2266-E2270. doi: https://doi.org/10.1210/jc.2012-2627
40. Zerwekh JE. Blood biomarkers of vitamin D status. Am J Clin Nutr. 2008;87(4):1087S-1091S. doi: https://doi.org/10.1093/ajcn/87.4.1087S
41. Saponaro F, Saba A, Zucchi R. An Update on Vitamin D Metabolism. Int J Mol Sci. 2020;21(18):6573. doi: https://doi.org/10.3390/ijms21186573
42. Saponaro F, Saba A, Zucchi R. An Update on Vitamin D Metabolism. Int J Mol Sci. 2020;21(18):6573. doi: https://doi.org/10.3390/ijms21186573
43. Chun RF, Peercy BE, Orwoll ES, Nielson CM, Adams JS, Hewison M. Vitamin D and DBP: The free hormone hypothesis revisited. J Steroid Biochem Mol Biol. 2014;144:132-137. doi: https://doi.org/10.1016/j.jsbmb.2013.09.012
44. Abboud M, Puglisi DA, Davies BN, et al. Evidence for a Specific Uptake and Retention Mechanism for 25-Hydroxyvitamin D (25OHD) in Skeletal Muscle Cells. Endocrinology. 2013;154(9):3022-3030. doi: https://doi.org/10.1210/en.2012-2245
45. Hernando N, Pastor‐Arroyo EM, Marks J, et al. 1,25(OH) 2 vitamin D 3 stimulates active phosphate transport but not paracellular phosphate absorption in mouse intestine. J Physiol. 2021;599(4):1131-1150. doi: https://doi.org/10.1113/JP280345
46. Saito H, Maeda A, Ohtomo S ichi, et al. Circulating FGF-23 Is Regulated by 1α,25-Dihydroxyvitamin D3 and Phosphorus in Vivo. Journal of Biological Chemistry. 2005;280(4):2543-2549. doi: https://doi.org/10.1074/jbc.M408903200
47. Verlinden L, Carmeliet G. Integrated View on the Role of Vitamin D Actions on Bone and Growth Plate Homeostasis. JBMR Plus. 2021;5(12). doi: https://doi.org/10.1002/jbm4.10577
48. Nemere I, Dormanen MC, Hammond MW, Okamura WH, Norman AW. Identification of a specific binding protein for 1 alpha,25-dihydroxyvitamin D3 in basal-lateral membranes of chick intestinal epithelium and relationship to transcaltachia. Journal of Biological Chemistry. 1994;269(38):23750-23756. doi: https://doi.org/10.1016/S0021-9258(17)31579-X
49. Buitrago C, Pardo VG, Boland R. Role of VDR in 1α,25-dihydroxyvitamin D3-dependent non-genomic activation of MAPKs, Src and Akt in skeletal muscle cells. J Steroid Biochem Mol Biol. 2013;136:125-130. doi: https://doi.org/10.1016/j.jsbmb.2013.02.013
50. Vassalotti JA, Uribarri J, Chen SC, et al. Trends in Mineral Metabolism: Kidney Early Evaluation Program (KEEP) and the National Health and Nutrition Examination Survey (NHANES) 1999-2004. American Journal of Kidney Diseases. 2008;51(4):S56-S68. doi: https://doi.org/10.1053/j.ajkd.2007.12.018
51. Moranne O, Froissart M, Rossert J, et al. Timing of Onset of CKD-Related Metabolic Complications. Journal of the American Society of Nephrology. 2009;20(1):164-171. doi: https://doi.org/10.1681/ASN.2008020159
52. Hu MC, Kuro-o M, Moe OW. The emerging role of Klotho in clinical nephrology. Nephrology Dialysis Transplantation. 2012;27(7):2650-2657. doi: https://doi.org/10.1093/ndt/gfs160
53. Dusso A, González EA, Martin KJ. Vitamin D in chronic kidney disease. Best Pract Res Clin Endocrinol Metab. 2011;25(4):647-655. doi: https://doi.org/10.1016/j.beem.2011.05.005
54. Isakova T, Wahl P, Vargas GS, et al. Fibroblast growth factor 23 is elevated before parathyroid hormone and phosphate in chronic kidney disease. Kidney Int. 2011;79(12):1370-1378. doi: https://doi.org/10.1038/ki.2011.47
55. Dusso AS, Tokumoto M. Defective renal maintenance of the vitamin D endocrine system impairs vitamin D renoprotection: a downward spiral in kidney disease. Kidney Int. 2011;79(7):715-729. doi: https://doi.org/10.1038/ki.2010.543
56. Mehrotra R, Kermah D, Budoff M, et al. Hypovitaminosis D in Chronic Kidney Disease. Clinical Journal of the American Society of Nephrology. 2008;3(4):1144-1151. doi: https://doi.org/10.2215/CJN.05781207
57. Michaud J, Naud J, Ouimet D, et al. Reduced Hepatic Synthesis of Calcidiol in Uremia. Journal of the American Society of Nephrology. 2010;21(9):1488-1497. doi: https://doi.org/10.1681/ASN.2009080815
58. Hsu CH, Patel S. Uremic plasma contains factors inhibiting 1 alphahydroxylase activity. Journal of the American Society of Nephrology. 1992;3(4):947-952. doi: https://doi.org/10.1681/ASN.V34947
59. Bachmann S, Schlichting U, Geist B, et al. Kidney-Specific Inactivation of the Megalin Gene Impairs Trafficking of Renal Inorganic Sodium Phosphate Cotransporter (NaPi-IIa). Journal of the American Society of Nephrology. 2004;15(4):892-900. doi: https://doi.org/10.1097/01.ASN.0000120389.09938.21
60. Hyder R, Sprague SM. Secondary Hyperparathyroidism in a Patient with CKD. Clinical Journal of the American Society of Nephrology. 2020;15(7):1041-1043. doi: https://doi.org/10.2215/CJN.13411119
61. Galitzer H, Ben-Dov IZ, Silver J, Naveh-Many T. Parathyroid cell resistance to fibroblast growth factor 23 in secondary hyperparathyroidism of chronic kidney disease. Kidney Int. 2010;77(3):211-218. doi: https://doi.org/10.1038/ki.2009.464
62. Jørgensen HS, de Loor H, Billen J, et al. Vitamin D Metabolites Before and After Kidney Transplantation in Patients Who Are Anephric. American Journal of Kidney Diseases. 2024;84(4):427-436.e1. doi: https://doi.org/10.1053/j.ajkd.2024.03.025
63. Dai B, David V, Alshayeb HM, et al. Assessment of 24,25(OH)2D levels does not support FGF23-mediated catabolism of vitamin D metabolites. Kidney Int. 2012;82(10):1061-1070. doi: https://doi.org/10.1038/ki.2012.222
64. de Boer IH, Sachs MC, Chonchol M, et al. Estimated GFR and Circulating 24,25-Dihydroxyvitamin D3 Concentration: A Participant-Level Analysis of 5 Cohort Studies and Clinical Trials. American Journal of Kidney Diseases. 2014;64(2):187-197. doi: https://doi.org/10.1053/j.ajkd.2014.02.015
65. Hsu S, Zelnick LR, Lin YS, et al. Validation of the 24,25-dihydroxyvitamin D3 to 25-hydroxyvitamin D3 ratio as a biomarker of 25-hydroxyvitamin D3 clearance. J Steroid Biochem Mol Biol. 2022;217:106047. doi: https://doi.org/10.1016/j.jsbmb.2021.106047
66. Turner ME, Rowsell TS, White CA, et al. The metabolism of 1,25(OH)2D3 in clinical and experimental kidney disease. Sci Rep. 2022;12(1):10925. doi: https://doi.org/10.1038/s41598-022-15033-9
67. https://kdigo.org/wp-content/uploads/2017/02/KDIGO-2009-CKDMBD-Guideline-English.pdf
68. Jayedi A, Soltani S, Shab-Bidar S. Vitamin D Status and All-Cause Mortality in Patients With Chronic Kidney Disease: A Systematic Review and Dose-Response Meta-Analysis. J Clin Endocrinol Metab. 2017;102(7):2136-2145. doi: https://doi.org/10.1210/jc.2017-00105
69. Yeung WCG, Palmer SC, Strippoli GFM, et al. Vitamin D Therapy in Adults With CKD: A Systematic Review and Meta-analysis. American Journal of Kidney Diseases. 2023;82(5):543-558. doi: https://doi.org/10.1053/j.ajkd.2023.04.003
70. Российская ассоциация эндокринологов. Дефицит витамина D: клинические рекомендации. 2021. URL: https://rae-org.ru/system/files/documents/pdf/d_2021.pdf (дата обращения: 10.02.2025).
71. Ennis JL, Worcester EM, Coe FL, Sprague SM. Current recommended 25-hydroxyvitamin D targets for chronic kidney disease management may be too low. J Nephrol. 2016;29(1):63-70. doi: https://doi.org/10.1007/s40620-015-0186-0
72. Bikle D, Bouillon R, Thadhani R, Schoenmakers I. Vitamin D metabolites in captivity? Should we measure free or total 25(OH)D to assess vitamin D status? J Steroid Biochem Mol Biol. 2017;173:105-116. doi: https://doi.org/10.1016/j.jsbmb.2017.01.007
73. Castillo-Peinado L de los S, Calderón-Santiago M, Herrera-Martínez AD, et al. Measuring Vitamin D3 Metabolic Status, Comparison between Vitamin D Deficient and Sufficient Individuals. Separations. 2022;9(6):141. doi: https://doi.org/10.3390/separations9060141
74. Bosworth CR, Levin G, Robinson-Cohen C, et al. The serum 24,25-dihydroxyvitamin D concentration, a marker of vitamin D catabolism, is reduced in chronic kidney disease. Kidney Int. 2012;82(6):693-700. doi: https://doi.org/10.1038/ki.2012.193
75. Lee S, Chung HJ, Jung S, et al. 24,25-Dihydroxy Vitamin D and Vitamin D Metabolite Ratio as Biomarkers of Vitamin D in Chronic Kidney Disease. Nutrients. 2023;15(3):578. doi: https://doi.org/10.3390/nu15030578
76. Galassi A, Fasulo EM, Ciceri P, et al. 1,25-dihydroxyvitamin D as Predictor of Renal Worsening Function in Chronic Kidney Disease. Results From the PASCaL-1,25D Study. Front Med (Lausanne). 2022;9. doi: https://doi.org/10.3389/fmed.2022.840801
77. Tentori F, Blayney MJ, Albert JM, et al. Mortality Risk for Dialysis Patients With Different Levels of Serum Calcium, Phosphorus, and PTH: The Dialysis Outcomes and Practice Patterns Study (DOPPS). American Journal of Kidney Diseases. 2008;52(3):519-530. doi: https://doi.org/10.1053/j.ajkd.2008.03.020
78. Cozzolino M, Brancaccio D, Cannella G, et al. VDRA therapy is associated with improved survival in dialysis patients with serum intact PTH <=150 pg/mL: results of the Italian FARO Survey. Nephrology Dialysis Transplantation. 2012;27(9):3588-3594. doi: https://doi.org/10.1093/ndt/gfs108
79. Yu Y, Diao Z, Wang Y, Zhou P, Ding R, Liu W. Hemodialysis patients with low serum parathyroid hormone levels have a poorer prognosis than those with secondary hyperparathyroidism. Ther Adv Endocrinol Metab. 2020;11. doi: https://doi.org/10.1177/2042018820958322
80. Thadhani R, Appelbaum E, Pritchett Y, et al. Vitamin D Therapy and Cardiac Structure and Function in Patients With Chronic Kidney Disease. JAMA. 2012;307(7):674. doi: https://doi.org/10.1001/jama.2012.120
81. Wang AYM, Fang F, Chan J, et al. Effect of Paricalcitol on Left Ventricular Mass and Function in CKD—The OPERA Trial. Journal of the American Society of Nephrology. 2014;25(1):175-186. doi: https://doi.org/10.1681/ASN.2013010103
82. Bellasi A, Mandreoli M, Baldrati L, et al. Chronic Kidney Disease Progression and Outcome According to Serum Phosphorus in Mild-to-Moderate Kidney Dysfunction. Clinical Journal of the American Society of Nephrology. 2011;6(4):883-891. doi: https://doi.org/10.2215/CJN.07810910
83. Lopes MB, Karaboyas A, Bieber B, et al. Impact of longer term phosphorus control on cardiovascular mortality in hemodialysis patients using an area under the curve approach: results from the DOPPS. Nephrology Dialysis Transplantation. 2020;35(10):1794-1801. doi: https://doi.org/10.1093/ndt/gfaa054
84. Fan Z, Li R, Pan M, et al. Relationship between serum phosphorus and mortality in non-dialysis chronic kidney disease patients: evidence from NHANES 2001–2018. BMC Nephrol. 2024;25(1):89. doi: https://doi.org/10.1186/s12882-024-03525-x
85. Lim LM, Kuo HT, Kuo MC, et al. Low serum calcium is associated with poor renal outcomes in chronic kidney disease stages 3–4 patients. BMC Nephrol. 2014;15(1):183. doi: https://doi.org/10.1186/1471-2369-15-183
86. Janmaat CJ, van Diepen M, Gasparini A, et al. Lower serum calcium is independently associated with CKD progression. Sci Rep. 2018;8(1):5148. doi: https://doi.org/10.1038/s41598-018-23500-5
87. Hiyamuta H, Yamada S, Taniguchi M, Nakano T, Tsuruya K, Kitazono T. Causes of death in patients undergoing maintenance hemodialysis in Japan: 10-year outcomes of the Q-Cohort Study. Clin Exp Nephrol. 2021;25(10):1121-1130. doi: https://doi.org/10.1007/s10157-021-02089-6
88. Yamaguchi S, Hamano T, Doi Y, et al. Hidden Hypocalcemia as a Risk Factor for Cardiovascular Events and All-Cause Mortality among Patients Undergoing Incident Hemodialysis. Sci Rep. 2020;10(1):4418. doi: https://doi.org/10.1038/s41598-020-61459-4
89. Kim ED, Watt J, Tereshchenko LG, et al. Associations of serum and dialysate electrolytes with QT interval and prolongation in incident hemodialysis: the Predictors of Arrhythmic and Cardiovascular Risk in End-Stage Renal Disease (PACE) study. BMC Nephrol. 2019;20(1):133. doi: https://doi.org/10.1186/s12882-019-1282-5
90. Taniguchi M, Fukagawa M, Fujii N, et al. Serum Phosphate and Calcium Should Be Primarily and Consistently Controlled in Prevalent Hemodialysis Patients. Therapeutic Apheresis and Dialysis. 2013;17(2):221-228. doi: https://doi.org/10.1111/1744-9987.12030
91. Block GA, Klassen PS, Lazarus JM, Ofsthun N, Lowrie EG, Chertow GM. Mineral Metabolism, Mortality, and Morbidity in Maintenance Hemodialysis. Journal of the American Society of Nephrology. 2004;15(8):2208-2218. doi: https://doi.org/10.1097/01.ASN.0000133041.27682.A2
92. Yamada S, Arase H, Tokumoto M, et al. Increased Risk of Infection-Related and All-Cause Death in Hypercalcemic Patients Receiving Hemodialysis: The Q-Cohort Study. Sci Rep. 2020;10(1):6327. doi: https://doi.org/10.1038/s41598-020-63334-8
93. Yamada S, Giachelli CM. Vascular calcification in CKD-MBD: Roles for phosphate, FGF23, and Klotho. Bone. 2017;100:87-93. doi: https://doi.org/10.1016/j.bone.2016.11.012
94. Pasch A, Block GA, Bachtler M, et al. Blood Calcification Propensity, Cardiovascular Events, and Survival in Patients Receiving Hemodialysis in the EVOLVE Trial. Clinical Journal of the American Society of Nephrology. 2017;12(2):315-322. doi: https://doi.org/10.2215/CJN.04720416
95. Henderson RR, Santiago LM, Spring DA, Harrington AR. Metastatic Myocardial Calcification in Chronic Renal Failure Presenting as Atrioventricular Block. New England Journal of Medicine. 1971;284(22):1252-1253. doi: https://doi.org/10.1056/NEJM197106032842208
Об авторах
А. С. БондаренкоРоссия
Бондаренко Аксения Сергеевна
117292, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Л. Я. Рожинская
Россия
Рожинская Людмила Яковлевна, д.м.н., профессор
117292, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. Ю. Жуков
Россия
Жуков Артем Юрьевич
117292, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна, д.м.н.
117292, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Г. А. Мельниченко
Россия
Мельниченко Галина Афанасьевна, д.м.н., профессор
117292, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Упрощенная схема метаболизма витамина D в физиологических условиях. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(295KB)
|
Метаданные ▾ | |
|
|
2. Риcунок 2. Основные лабораторные изменения, характерные для МКН-ХБП, в зависимости от стадии нарушения почечной функции. Адаптировано из [52]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(273KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Бондаренко А.С., Рожинская Л.Я., Жуков А.Ю., Белая Ж.Е., Мельниченко Г.А. Особенности метаболизма витамина D и регуляции кальций-фосфорного обмена у пациентов с хронической болезнью почек. Остеопороз и остеопатии. 2025;28(1):28-37. https://doi.org/10.14341/osteo13197
For citation:
Bondarenko A.S., Rozhinskaya L.Ya., Zhukov A.Yu., Belaya Zh.E., Melnichenko G.A. Vitamin D metabolism and regulation of calciumphosphorus homeostasis in patients with chronic kidney disease. Osteoporosis and Bone Diseases. 2025;28(1):28-37. (In Russ.) https://doi.org/10.14341/osteo13197

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































