Перейти к:
Клинический случай фосфопенической формы остеомаляции вследствие паранеопластической секреции метастатического рака предстательной железы
https://doi.org/10.14341/osteo12948
Аннотация
Фосфатурическая мезенхимальная опухоль может служить причиной остеомаляции из-за избыточной секреции фактора роста фибробластов 23 (ФРФ23), нарушающего метаболизм фосфора и витамина D. Образования преимущественно доброкачественные, однако менее чем в 5% встречаются злокачественные формы. В статье представлен первый в Российской Федерации клинический случай пациента 69 лет с выраженной гипофосфатемией, вследствие метастатического рака предстательной железы. Именно для андроген-нечувствительной формы описана возможность секреции ФРФ23, что привело к выраженным нарушениям минерального обмена, сопровождающихся клинической картиной слабости, болевым синдромом в костях, обездвиживанием пациента. Состояние было расценено как ухудшение на фоне прогрессирования заболевания. Однако симптоматическая терапия, направленная на повышение уровня фосфора в организме, позволила значительно улучшить общее состояние пациента. Медицинское сообщество должно быть осведомлено о возможности развития гипофосфатемии у пациентов со слабостью, болью в костях на фоне метастатического рака предстательной железы.
Ключевые слова
Для цитирования:
Гронская С.А., Голоунина О.О., Буклемишев Ю.В., Хайриева А.В., Дегтярев М.В., Рожинская Л.Я., Белая Ж.Е. Клинический случай фосфопенической формы остеомаляции вследствие паранеопластической секреции метастатического рака предстательной железы. Остеопороз и остеопатии. 2022;25(4):43-51. https://doi.org/10.14341/osteo12948
For citation:
Gronskaya S.A., Golounina O.O., Buklemishev Yu.V., Khairieva A.V., Degtyarev M.V., Rozhinskaya L.Ya., Belaya Zh.E. A clinical case of phosphopenic osteomalacia due to paraneoplastic secretion of metastatic prostate cance. Osteoporosis and Bone Diseases. 2022;25(4):43-51. (In Russ.) https://doi.org/10.14341/osteo12948
АКТУАЛЬНОСТЬ
Фосфопеническая форма остеомаляции, также известная как онкогенная остеомаляция, представляет собой крайне редкий приобретенный паранеопластический синдром, характеризующийся нарушением минерализации кости, накоплением неминерализованного остеоида и выраженной потерей фосфатов почками [1]. Наиболее частой причиной онкогенной остеомаляции является мезенхимальная опухоль, секретирующая фосфатурический гормон — фактор роста фибробластов 23 (ФРФ23). Избыточная продукция ФРФ23 сопровождается развитием гипофосфатемии, ингибирует реабсорбцию фосфатов и нарушает 1α-гидроксилирование 25(ОН)D. Наиболее частая локализация образований — нижние конечности, голова, таз, верхние конечности [2]. В клинической картине преобладают диффузные боли в костях, прогрессирующая мышечная слабость, развитие множественных патологических переломов. Онкогенная остеомаляция нередко становится причиной ошибочного диагноза остеопороза или метастатического поражения костей скелета [3].
Остеомаляция, индуцированная опухолью, в редких случаях может быть связана со злокачественными новообразованиями, такими как рак предстательной железы [4][5], рак молочной железы [6], анапластический рак щитовидной железы [7], рак толстой кишки [8], мелкоклеточный рак легкого [9], все из которых являются немезенхимальными опухолями, но претерпевают эпителиально-мезенхимальный переход в процессе метастазирования. Симптомы, характерные для фосфопенической остеомаляции опухолевого генеза, у пациентов с онкологическими заболеваниями могут быть связаны с существующим онкологическим процессом, и потенциальный диагноз опухоль-индуцированной остеомаляции может быть не установлен. В связи сэтим важно учитывать онкогенную остеомаляцию при дифференциальной диагностике у пациентов со злокачественными новообразованиями, у которых наблюдается гипофосфатемия. Кроме того, подобные случаи представляют дополнительные трудности в связи с использованием антирезорбтивной терапии у пациентов с метастазами в кости, которая может вызвать избыточную экспрессию ФРФ23 и усугубить онкогенную остеомаляцию.
В статье впервые в Российской Федерации представлен клинический случай пациента с выраженной гипофосфатемией на фоне метастатического рака предстательной железы, приведены особенности диагностики и лечения.
ОПИСАНИЕ СЛУЧАЯ
Пациент П., 69 лет, впервые обратился в ФГБУ «НМИЦ травматологии и ортопедии им. Н.Н. Приорова» Минздрава России с жалобами на боли в костях, боли в коленных суставах, выраженную мышечную слабость, преимущественно в нижних конечностях, трудности при ходьбе (передвигался в инвалидной коляске).
Из анамнеза известно, что при плановой диспансеризации в возрасте 63 лет впервые было выявлено повышение уровня простатспецифического антигена до 250 нг/мл, в связи с чем пациент был направлен в онкологический диспансер по месту жительства. При дообследовании установлен диагноз рака предстательной железы, IV стадия Т3N0M1. Проведены 11 курсов химиотерапии с поддерживающей гормональной терапией преднизолоном в дозе 10 мг в сутки с последующим уменьшением дозы до 5 мг в сутки, которую пациент продолжает принимать по настоящее время, терапия антиандрогенами, аналогами гонадотропин-рилизинг-гормона. Однократно проводилась инфузия золедроновой кислоты в дозе 4 мг.
В возрасте 67 лет пациент стал отмечать постепенно нарастающую боль в коленных суставах. По данным рентгенографии — картина гонартроза. Назначалась терапия нестероидными противовоспалительными препаратами, однако субъективно улучшения самочувствия не отмечал, выраженность болей увеличивалась. В связи с постепенным ухудшением состояния, развитием мышечной слабости в ногах с возраста 68 лет стал передвигаться с опорой на костыли, с 69 лет передвигается в инвалидной коляске. В качестве обезболивающей терапии ежедневно принимал трамадол по 100 мг 4 раза в сутки, через каждые 6 ч.
При плановом обследовании по данным мультиспиральной компьютерной томографии (МСКТ) определялись очаги в костях смешанного генеза: в переднем и боковом отрезках 3-го ребра справа (толщина mts 22 мм), в заднемедиальном — 6-го ребра справа (толщина mts 20 мм), в седалищных костях и в правой лонной кости, в головке и шейке левой бедренной кости. По результатам рентгенографии: множественные очаги зон перестройки костной ткани, множественные патологические переломы костей скелета — костей таза, позвонков, шееек обеих бедренных костей, верхней трети большеберцовых костей с двух сторон. По месту жительства проводилась остеоденситометрия, выявлено выраженное снижение минеральной плотности кости (МПК) в проксимальном отделе бедренной кости до -4,8SD по Т-критерию, в целом в бедре до -4,0SD по Т-критерию, МПК в поясничном отделе позвоночника в пределах нормальных значений. Тогда же впервые при лабораторном обследовании выявлены снижение уровня фосфора до 0,4 ммоль/л (0,74–1,52), повторно — 0,49 ммоль/л, гипокальциемия (кальций общий 1,94 ммоль/л (2,15–2,55), кальций ионизированный 1,14 ммоль/л (1,09–1,35)), повышение уровня щелочной фосфатазы (ЩФ) до 382 Ед/л (50–150). Далее пациент поступил в отделение нейроэндокринологии и остеопатий ФГБУ «НМИЦ эндокринологии» Минздрава России.
На момент поступления в отделение пациент получал альфакальцидол 1,5 мкг в сутки, назначенный изначально в ФГБУ «НМИЦ травматологии и ортопедии им. Н.Н. Приорова», пероральную сахароснижающую терапию по поводу сахарного диабета 2 типа, гипотензивную терапию.
При осмотре в отделении: рост 172 см (снижение в росте на 10 см за жизнь), масса тела 85 кг, индекс массы тела 28,7 кг/м2. В ходе расширенного лабораторного обследования в стационаре сохранялись гипофосфатемия в сочетании со сниженным индексом тубулярной реабсорбции фосфатов, повышение уровня ЩФ (табл. 1). По результатам МСКТ — патологические переломы 4–10-го ребер справа и 5–9-го ребер слева в стадии консолидации, множественные застарелые компрессионные переломы тел Th2–8, Th10, Th12, L1–3, L5, смешанная перестройка правых лонной и седалищной кости с формированием патологического перелома и остеобластическая перестройка левой седалищной кости, более соответствующие вторичным изменениям (mts), однако нельзя полностью исключить изменения, являющиеся следствием опухоль-индуцированной остеомаляции, изменения 3, 6-го ребер справа более соответствуют фиброзной дисплазии или опухоль-индуцированной остеомаляции (рис. 1, 2). На основании данных анамнеза, лабораторных и инструментальных исследований установлен диагноз «фосфопеническая форма остеомаляции опухолевого генеза», инициирована терапия препаратами фосфора и увеличена доза альфакальцидола до 4 мкг. На фоне проводимой терапии отмечалось повышение уровня фосфора с 0,38 до 0,48 ммоль/л, снижение активности ЩФ, пациент субъективно отметил уменьшение выраженности болей в костях.
Таблица 1. Данные лабораторного обследования пациента П. при первичном обращении в ФГБУ «НМИЦ эндокринологии» Минздрава России и в динамике
|
Параметр |
При первичном обращении |
Через 6 мес |
Референсный интервал |
|
Кальций общий, ммоль/л |
2,28 |
2,31 |
2,15–2,55 |
|
Кальций ионизированный, ммоль/л |
1,10 |
1,14 |
1,03–1,29 |
|
Фосфор, ммоль/л |
0,38 |
0,65 |
0,74–1,52 |
|
ЩФ, Ед/л |
312 |
261 |
40–150 |
|
ПТГ, нг/мл |
23,9 |
17,37 |
15–65 |
|
Креатинин, мкмоль/л |
72,9 |
86,5 |
63–110 |
|
Индекс тубулярной реабсорбции фосфатов, % |
74,68 |
56,8 |
85–95 |
|
Кальций в суточной моче, ммоль/сут |
3,95 |
7,45 |
2,5–8 |
|
С-концевой телопептид коллагена 1-го типа, нг/мл |
0,513 |
1,17 |
0,1–0,85 |
|
Гликированный гемоглобин, % |
6 |
6,5 |
4–6 |
|
Простатспецифический антиген, нг/мл |
27,61 |
– |
0–4 |

Рисунок 1. МСКТ позвоночника пациента П.
Описание: А) остеосклеротические очаги в теле Th1 и Th11 позвонков (стрелки); Б) в боковом и заднем отрезках 3-го ребра справа бластоматозная трансформация, множественные компрессионные переломы тел позвонков.
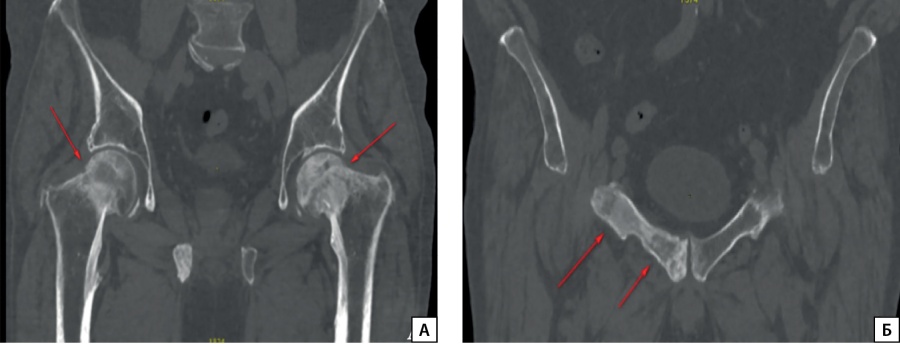
Рисунок 2. МСКТ костей таза
Описание: А) в головках и шейках бедренных костей зоны остеосклероза без четких контуров, с наличием патологического перелома шейки правой бедренной кости (стрелка); Б) очаги остеосклероза в правых лонной и седалищной костях с формированием патологического перелома (стрелка) и остеобластическая перестройка левой седалищной кости
Для топической диагностики проведена соматостатин-рецепторная сцинтиграфия в режиме «все тело» с 99mTc-тектротидом. Отмечается гиперфиксация радиофармацевтического препарата в очагах пораженных костей (рис. 3.1, 3.2), что свидетельствует о наличии соматостатиновых рецепторов в этих участках, и, наиболее вероятно, метастатическое поражение является источником продукции ФРФ23.
На момент последнего наблюдения на фоне ежедневной терапии препаратами фосфора и активными метаболитами витамина D (альфакальцидол 4 мкг/сут) отмечена положительная динамика в виде увеличения уровня фосфора до 0,65 ммоль/л, снижения активности ЩФ до 261 Ед/л, сохранения нормокальциемии (динамика показателей кальций-фосфорного обмена в сыворотке крови и суточной кальциурии представлена в табл. 1).
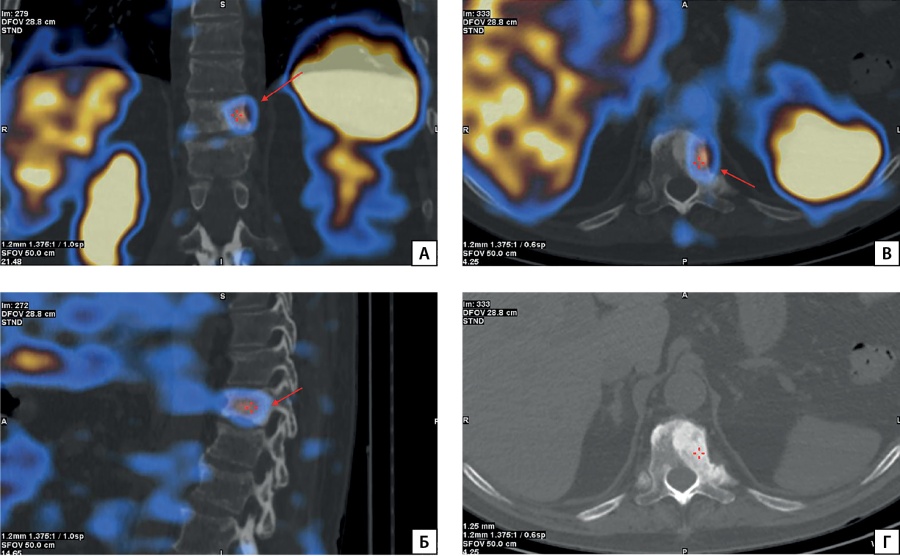
Рисунок 3.1. Результаты ОФЭКТ/КТ пациента П.
Описание: в левой половине тела с распространением на ножку дуги Th11 позвонка визуализируется очаг остеосклероза с ровными контурами, размерами 43×22×22 мм, с повышенной фиксацией РФП (стрелки) во фронтальной (А), сагиттальной (Б), аксиальной (В, Г) плоскостях.
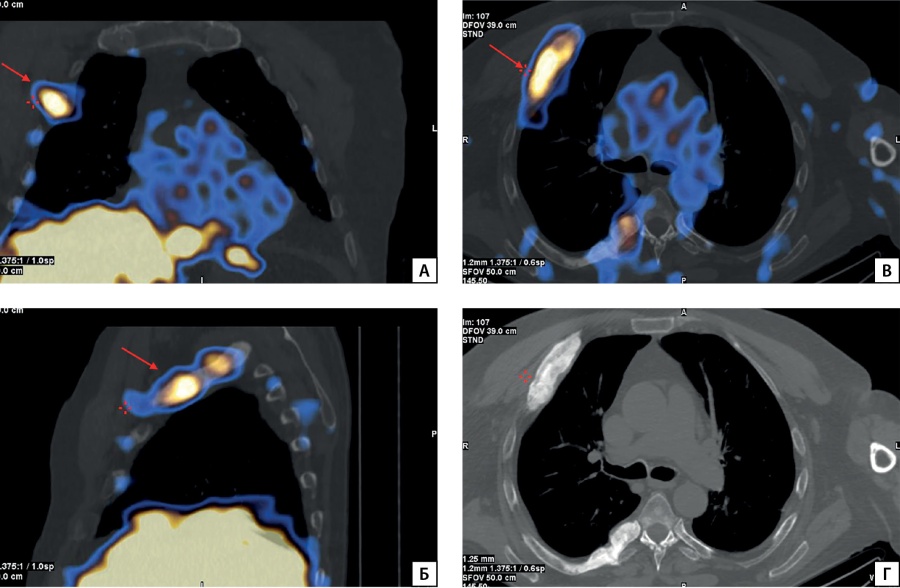
Рисунок 3.2. ОФЭКТ/КТ пациента П.
Описание: вздутие и неоднородность костной структуры переднего отрезка 3-го ребра справа (А) и заднего отрезка 6-го ребра справа (Б), кортикальный слой с неровными контурами с накоплением радиофармацевтического препарата (В, стрелки), плотность костной ткани повышена на всем протяжении (Г).
ОБСУЖДЕНИЕ
В статье представлен клинический случай развития остеомаляции вследствие секреции ФРФ23 метастазами рака предстательной железы. Способностью секретировать ФРФ23 обладают остеоциты и их предшественники, по сути дела, это мезенхимальные стволовые клетки на различных этапах дифференцировки в сторону остеобласта/остеоцита, которые и составляют секреторную часть опухоли. Гиперсекреция ФРФ23 описана для ряда доброкачественных опухолей мезенхимального происхождения: гемангиоперицитомы, липомы, опухоли околоушной железы [2][10][11]. Концепцию объединения под термином «фосфатурических мезенхимальных опухолей» гетерогенных опухолей костей и мягких тканей, секретирующих фосфатурические гормоны, предложил в 1987 г. Weidner N. и соавт. [12]. В общей сложности в мире на 2022 г. зафиксировано 1725 случаев. Менее 5% случаев связано со злокачественными опухолями. Это были пациенты в возрасте от 5 до 62 лет, большинство из них — взрослые в возрасте 35–40 лет, соотношение мужчин и женщин 1:2. Опухоли поражали гортань, язык, печень, таз и конечности. Прогноз неблагоприятный. Описаны также случаи злокачественной трансформации мезенхимальной фосфатурической опухоли в саркому, с мутациями в гене TP53, причем время от начала заболевания до трансформации широко варьировалось от момента первого проявления до более чем 20 лет спустя. Предикторов злокачественной трансформации обнаружено не было, за исключением распространенности процесса, быстрого роста опухоли. Концентрация в крови биологически активной формы — интактного ФРФ23 (иФРФ23) — не влияла на прогноз заболевания [13].
Рак предстательной железы является немезенхимальной опухолью, которая может претерпевать эпителиально-мезенхимальный переход в процессе метастазирования. У пациентов с раком предстательной железы, начиная с первого сообщения в1975 г., было описано еще около 25 случаев, и у большинства из них наблюдались метастазы в костях и андроген-нечувствительная форма рака предстательной железы [14]. В случае злокачественных образований гипофосфатемия может быть отделена по времени, т.е. появиться за годы до или месяцы спустя после постановки диагноза онкологического заболевания [13].
Наиболее распространенным фосфатурическим соединением, которое способны секретировать опухоли, является именно ФРФ23. Из-за потерь фосфора с мочой развиваются гипофосфатемия, остеомаляция, неадекватно низкие уровни 1,25(ОН)2D. Уровни 25-гидроксивитамина D и кальция в сыворотке крови обычно в норме. Также типичным признаком является повышение активности ЩФ в сыворотке крови, а уровни ПТГ могут быть как нормальными, так и повышенными, но чаще всего остаются в референсном интервале [15][16].
В клинической картине наблюдаются последствия тяжелой гипофосфатемии: выраженная слабость, боли в костях, проксимальная миопатия, желудочно-кишечные расстройства [9]. Необходимо отметить, что у представленного нами пациента были жалобы, характерные для гиперпродукции ФРФ23, — выраженная мышечная слабость и боли в костях. В данном случае возникшие у пациента боли и изменения в костях были, вероятно, расценены как остеопороз на фоне глюкокортикоидной и антиандрогенной терапии. По поводу костных метастазов однократно назначалась терапия золедроновой кислотой. Хотя золедроновая кислота и деносумаб доказали свою эффективность в снижении скелетных осложнений при андроген-нечувствительной форме рака предстательной железы, их следует применять с осторожностью у пациентов с остеомаляцией [17–19]. Легкая и преходящая гипофосфатемия является частым побочным эффектом деносумаба и золедроновой кислоты. Несмотря на то что применение антирезорбтивной терапии существенно снижает число скелетных осложнений онкологических заболеваний, уменьшает выраженность болевого синдрома, улучшает качество и, по некоторым данным, продолжительность жизни онкологических больных, назначение бисфосфонатов нежелательно при остеомаляции [20]. С учетом особенностей фармакокинетики бисфосфонатов, для лечения костных метастазов оптимально было бы использовать деносумаб, который не накапливается в костной ткани и с меньшей вероятностью влияет на процессы минерализации костной ткани [21]. Перед назначением антиостеопоротической терапии, для дифференциальной диагностики остеомаляции и остеопороза рекомендуется проведение дополнительных лабораторных исследований [22]. Поскольку этого в данном случае не произошло, диагноз остеомаляции был заподозрен только спустя 4 года, что очень типично. В 95% случаев пациенты длительно наблюдаются с остеопорозом, гиперпаратиреозом, различными вариантами артритов и другими заболеваниями минерального обмена [23][24].
У обсуждаемого пациента выявили типичные лабораторные признаки ФРФ23-индуцированной остеомаляции: гипофосфатемию 0,4 ммоль/л (0,74–1,52), гипокальциемию (кальций общий 1,94 ммоль/л (2,15–2,55)), повышение уровня ЩФ до 382 Ед/л (50–150). При обнаружении гипофосфатемии необходима оценка потери фосфора с мочой. Для этого рассчитывают тубулярный индекс реабсорбции фосфора (TRP, %). В норме индекс реабсорбции фосфора должен составлять 85–95% [25][26]. При ФРФ23-опухоли фосфор активно экскретируется с мочой, и TRP (%) составляет менее 85%. У представленного пациента TRP (%) был снижен и составил 74,68%.
Поиск ФРФ23-образований выполняют поэтапно. Вначале проводят «функциональную визуализацию», т.е. используют специфические радиофармпрепараты (РФП), которые накапливаются в ткани опухоли за счет наличия в ней соматостатиновых рецепторов 2А подтипа [27]. Применяется сцинтиграфия с РФП (99mTc-тектротид, 111In-октреотид) либо позитронно-эмиссионная томография с РФП (соли галлия: 68Ga DOTA-TATE/NOC). Затем осуществляют топический поиск опухоли: КТ, МРТ, УЗИ. При таком подходе удается верифицировать до 70% образований [28]. У пациента П. были обнаружены множественные очаги с гиперфиксацией РФП в очагах пораженных костей, что свидетельствует о наличии в метастазах соматостатиновых рецепторов,а значит, косвенно подтверждает секрецию ФРФ23.
Доброкачественные ФРФ23-опухоли обычно имеют диаметр не более 5 см, хотя были описаны и более крупные образования [19][29]. В РФ имеются описания отдельных клинических случаев доброкачественных ФРФ23-продуцирующих опухолей [1–3][24][30], однако первое описание принадлежит Родионовой С.С. в 1992 г. [31]. Опухоли преимущественно локализовались в нижних конечностях, в клинической картине преобладали множественные переломы и симптомы миопатии. Отличительными лабораторными признаками во всех случаях являлись выраженная гипофосфатемия и сниженный индекс тубулярной реабсорбции фосфатов. Хирургическое лечение выполнялось в расширенном объеме, так как опухоли чаще не инкапсулированы, могут врастать в окружающие ткани и визуально быть неотличимы от них [32]. В случае радикальной резекции восстановление уровня фосфора в крови регистрировалось на 3–7-е сутки после операции, и ремиссия сохранялась длительно. Персистирование заболевания после хирургического вмешательства встречается реже и, видимо, связано с диссеминацией опухолевых клеток [30]. К другим факторам риска рецидива относят женский пол, опухоли позвоночника, злокачественные новообразования [33].
Отличительным признаком злокачественной трансформации являются множественные метастазы, которые, однако, могут быть свойственны и доброкачественным опухолям [34][35]. Уровни иФРФ23 у пациентов с доброкачественными опухолями варьировались от 44,0 до 18286,4 пг/мл (среднее значение ±SD — 1304,1±3660,3). Ретроспективный анализ 144 случаев показал, что медиана концентраций иФРФ23 при доброкачественных образованиях составила 302,9 пг/мл (мин. 42,6, макс. 706,5) [23]. Для сравнения: в злокачественных опухолях уровень иФРФ23 сыворотки составил 121 пг/мл [36].
Широкая хирургическая резекция — метод выбора, поскольку других эффективных методов лечения (при злокачественном варианте) не существует. После успешной операции уровень фосфора восстанавливается уже на 5–10-е сутки. Касательно химиотерапии определенных рекомендаций нет. Seijas R. и соавт. [37] сообщали, что 6 циклов приема адриамицина остановили метастазирование на 2 года. Sidell D. и соавт. [38] использовали доксорубицин, доцетаксел и гемцитабин для химиотерапии злокачественной опухоли гортани. Morimoto T. и соавт. [36] предложили комбинированную химиотерапию, состоящую из адриамицина, ифосфамида, гемцитабина и доцетаксела. Однако из 5 пациентов, получивших химиотерапию поповоду злокачественных ФРФ23-опухолей, выжил только 1 пациент с опухолью гортани. Значимой взаимосвязи между лечением и результатами обнаружено не было [13].
В нашем случае радикальная операция была невозможна, поскольку продукция ФРФ23, скорее всего, связана с костными метастазами рака предстательной железы, в связи с чем назначалась консервативная, поддерживающая терапия: альфакальцидол 4–4,5 мкг/сут, колекальциферол в поддерживающих дозах, препараты фосфора 1–3 г/сут (по 3–4 приема в течение дня).
В зарубежной практике для купирования гипофосфатемии применяется антитело к ФРФ23 буросумаб (KRN23). Однако буросумаб действует симптоматически и не влияет на рост опухоли [39]. Разработан препарат, влияющий на рост опухоли благодаря пан-ингибированию ФРФ-рецепторов «BGJ398/infigratinib», однако его применение ограничено из-за выраженной токсичности [40]. Учитывая трудности в лечении, поиск дополнительных препаратов для терапии ФРФ23-образований остается актуальным.
На момент последнего наблюдения в мае 2022 г. на фоне терапии препаратами фосфора и активными метаболитами витамина D отмечена частично положительная динамика по уровню в крови фосфора, кальция, ЩФ. Отрицательная динамика в виде индекса тубулярной реабсорбции фосфатов (56,8% против 74,68%) объясняется прогрессированием паранеопластического процесса. Тем не менее пациент отметил уменьшение болевого синдрома, повышение мышечной силы и качества жизни на фоне терапии, что в данном случае можно считать хорошим результатом. В качестве мониторинга ФРФ23-образований исследуются показатели минерально-костного обмена, проводится инструментальная диагностика для оценки роста метастазов.
ЗАКЛЮЧЕНИЕ
Представленный клинический случай подчеркивает важность детальной оценки нарушений фосфорно-кальциевого обмена у пациентов с костными метастазами. Выявленное снижение уровня фосфора и его коррекция позволили значительно улучшить двигательную активность, уменьшить болевой синдром у пациента с метастазами рака предстательной железы и сочетанной фосфопенической остеомаляцией. Таким образом, мониторинг фосфора и кальция оптимально проводить у всех пациентов с костными метастазами андроген-резистентных форм рака предстательной железы для своевременного выявления и коррекции гипофосфатемии.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Согласие пациента. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Остеопороз и остеопатии».
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, связанных с публикацией настоящей статьи.
Финансирование. Работа проведена при финансовой поддержке Министерства здравоохранения Российской Федерации в рамках выполнения государственного задания «Разработка персонализированных подходов к диагностике и лечению пациентов с остеопорозом вследствие эндокринопатий на основании изучения молекулярно-генетических предикторов, применения инновационных методов диагностики и исследования патогенеза редких заболеваний скелета» № АААА-А20-120011690202-4.
Список литературы
1. Гребенникова Т.А., Умярова Д.Ш., Слащук К.Ю., и др. Фосфопеническая остеомаляция опухолевого генеза: клинический случай // Остеопороз и остеопатии. — 2018. — Т. 21. — №4. — С. 24-28. doi: https://doi.org/10.14341/osteo10264.
2. Родионова С.С., Снетков А.И., Акиньшина А.Д., и др. Фосфопеническая форма остеомаляции, индуцированная ФРФ23-секретирующей опухолью левой бедренной кости // Научно-практическая ревматология. — 2019. — Т. 57. — №6. — С. 708-712. doi: https://doi.org/10.14412/1995-4484-2019-708-712
3. Булычева И.В., Родионова С.С., Карпенко В.Ю., и др. Онкогенная остеомаляция/фосфатурическая мезенхимальная опухоль: клиническое наблюдение и обзор литературы // Саркомы костей, мягких тканей и опухоли кожи. — 2022. — Т. 14. — №1. — С. 48-54. doi: https://doi.org/10.17650/2782-3687-2022-14-1-48-54
4. Mak MP, da Costa e Silva VT, Martin RM, et al. Advanced prostate cancer as a cause of oncogenic osteomalacia: an underdiagnosed condition. Support Care Cancer. 2012;20(9):2195-2197. doi: https://doi.org/10.1007/s00520-012-1474-z
5. Layman AAK, Joshi S, Shah S. Metastatic prostate cancer presenting as tumour-induced osteomalacia. BMJ Case Rep. 2019;12(7):e229434. doi: https://doi.org/10.1136/bcr-2019-229434
6. Abramson M, Glezerman IG, Srinivasan M, et al. Hypophosphatemia and FGF23 tumor-induced osteomalacia in two cases of metastatic breast cancer. Clin Nephrol. 2021;95(2):104-111. doi: https://doi.org/10.5414/CN110242
7. Abate EG, Bernet V, Cortese C, Garner HW. Tumor induced osteomalacia secondary to anaplastic thyroid carcinoma: A case report and review of the literature. Bone Reports. 2016;5(2):81-85. doi: https://doi.org/10.1016/j.bonr.2015.11.004
8. Leaf DE, Pereira RC, Bazari H, Jüppner H. Oncogenic osteomalacia due to FGF23-expressing colon adenocarcinoma. J Clin Endocrinol Metab. 2013;98(3):887-891. doi: https://doi.org/10.1210/jc.2012-3473
9. Sauder A, Wiernek S, Dai X, et al. FGF23-Associated tumor-induced osteomalacia in a patient with small cell carcinoma. Int J Surg Pathol. 2016;24(2):116-120. doi: https://doi.org/10.1177/1066896915617828
10. Auethavekiat P, Roberts JR, Biega TJ, et al. Difficult diagnostic cases: CASE 3. oncogenic osteomalacia associated with hemangiopericytoma localized by octreotide scan. J Clin Oncol. 2005;23(15):3626-3628. doi: https://doi.org/10.1200/JCO.2005.05.043
11. Kinoshita Y, Takashi Y, Ito N, et al. Ectopic expression of Klotho in fibroblast growth factor 23 (FGF23)-producing tumors that cause tumor-induced rickets/osteomalacia (TIO). Bone Reports. 2019;10(15):100192. doi: https://doi.org/10.1016/j.bonr.2018.100192
12. Weidner N, Cruz DS. Phosphaturic mesenchymal tumors. A polymorphous group causing osteomalacia or rickets. Cancer. 1987;59(8):1442-1454. doi: https://doi.org/10.1002/1097-0142(19870415)59:8<1442::AID-CNCR2820590810>3.0.CO;2-Q
13. Oyama N, Kojima-Ishii K, Toda N, et al. Malignant transformation of phosphaturic mesenchymal tumor: a case report and literature review. Clin Pediatr Endocrinol. 2020;29(2):69-75. doi: https://doi.org/10.1297/cpe.29.69
14. Hosking DJ, Chamberlain MJ, Shortland-Webb WR. Osteomalacia and carcinoma of prostate with major redistribution of skeletal calcium. Br J Radiol. 1975;48(570):451-456. doi: https://doi.org/10.1259/0007-1285-48-570-451
15. Folpe AL. Phosphaturic mesenchymal tumors: A review and update. Semin Diagn Pathol. 2019;36(4):260-268. doi: https://doi.org/10.1053/j.semdp.2019.07.002
16. Sundaram M, McCarthy EF. Oncogenic osteomalacia. Skeletal Radiol. 2000;29(3):117-124. doi: https://doi.org/10.1007/s002560050581
17. Fizazi K, Carducci M, Smith M, et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet. 2011;377(9768):813-822. doi: https://doi.org/10.1016/S0140-6736(10)62344-6
18. Saad F, Gleason DM, Murray R, et al. Long-Term efficacy of zoledronic acid for the prevention of skeletal complications in patients with metastatic hormone-refractory prostate cancer. J Natl Cancer Inst. 2004;96(11):879-882. doi: https://doi.org/10.1093/jnci/djh141
19. Lesnyak O, Gladkova E, Aleksandrov N, et al. Treatment of high fracture risk patients in routine clinical practice. Arch Osteoporos. 2020;15(1):184. doi: https://doi.org/10.1007/s11657-020-00851-z
20. Голоунина О.О., Белая Ж.Е. Бисфосфонаты: 50 лет в медицинской практике // Consilium Medicum. — 2020. — Т. 22. — №4. — С. 66-73. [Golounina OO, Belaya ZE. Bisphosphonates: 50 years in clinical practice. Consilium Medicum. 2020;22(4):66-73. (In Russ.)]. doi: https://doi.org/10.26442/20751753.2020.4.200102.
21. Рожинская Л.Я., Гронская С.А., Мамедова Е.О., и др. Применение деносумаба для лечения остеопороза различного генеза в реальной клинической практике // Остеопороз и остеопатии. — 2020. — Т. 23. — №1. — С. 4-13. doi: https://doi.org/10.14341/osteo12415
22. Голоунина О.О., Рунова Г.Е., Фадеев В.В. Остеомаляция в практике эндокринолога: этиология, патогенез, дифференциальная диагностика с остеопорозом // Остеопороз и остеопатии. — 2019. — Т. 22. — №2. — С. 23-31. doi: https://doi.org/10.14341/osteo12117
23. Chong WH, Molinolo AA, Chen CC, Collins MT. Tumor-induced osteomalacia. Endocr Relat Cancer. 2011;18(3):R53-R77. doi: https://doi.org/10.1530/ERC-11-0006
24. Feng J, Jiang Y, Wang O, et al. The diagnostic dilemma of tumor induced osteomalacia: a retrospective analysis of 144 cases. Endocr J. 2017;64(7):675-683. doi: https://doi.org/10.1507/endocrj.EJ16-0587
25. Еремкина А.К., Мирная С.С., Горбачева А.М., и др. Случай гипофосфатемической остеомаляции опухолевого генеза // Ожирение и метаболизм. — 2020. — Т. 17. — №2. — С. 220-227. doi: https://doi.org/10.14341/omet12472.
26. Payne RB. Renal tubular reabsorption of phosphate (TmP/GFR): indications and interpretation. Ann Clin Biochem. 1998;35(Pt2):201-206. doi: https://doi.org/10.1177/000456329803500203
27. Folpe AL, Fanburg-Smith JC, Billings SD, et al. Most Osteomalacia-associated Mesenchymal Tumors Are a Single Histopathologic Entity. Am J Surg Pathol. 2004;28(1):1-30. doi: https://doi.org/10.1097/00000478-200401000-00001
28. Gibril F. Somatostatin Receptor Scintigraphy: Its Sensitivity Compared with That of Other Imaging Methods in Detecting Primary and Metastatic Gastrinomas: A Prospective Study. Ann Intern Med. 1996;125(1):26. doi: https://doi.org/10.7326/0003-4819-125-1-199607010-00005
29. Yavropoulou MP, Gerothanasi N, Frydas A, et al. Tumor-induced osteomalacia due to a recurrent mesenchymal tumor overexpressing several growth factor receptors. Endocrinol Diabetes Metab Case Rep. 2015;2015:150025. doi: https://doi.org/10.1530/EDM-15-0025
30. Пушкарева А.С., Бибик Е.Е., Еремкина А.К., и др. Фосфопеническая форма остеомаляции у пациента с опухолью, продуцирующей фактор роста фибробластов 23 // Научно-практическая ревматология. — 2022. — Т. 60. — №2. — С. 249-255. doi: https://doi.org/10.47360/1995-4484-2022-249-255
31. Родионова С.С. Метаболические остеопатии: системный остеопороз и остеомаляция у взрослых. Дис. … д-ра мед. наук. М.; 1992.
32. Florenzano P, Hartley IR, Jimenez M, et al. Tumor-induced osteomalacia. Calcif Tissue Int. 2021;108(1):128-142. doi: https://doi.org/10.1007/s00223-020-00691-6
33. Li X, Jiang Y, Huo L, et al. Nonremission and Recurrent Tumor‐Induced Osteomalacia: A Retrospective Study. J Bone Miner Res. 2020;35(3):469-477. doi: https://doi.org/10.1002/jbmr.3903
34. Yamada Y, Kinoshita I, Kenichi K, et al. Histopathological and genetic review of phosphaturic mesenchymal tumours, mixed connective tissue variant. Histopathology. 2018;72(3):460-471. doi: https://doi.org/10.1111/his.13377
35. Uchihashi K, Nishijima-Matsunobu A, Matsuyama A, et al. Phosphaturic mesenchymal tumor, nonphosphaturic variant, causing fatal pulmonary metastasis. Hum Pathol. 2013;44(11):2614-2618. doi: https://doi.org/10.1016/j.humpath.2013.04.027
36. Morimoto T, Takenaka S, Hashimoto N, et al. Malignant phosphaturic mesenchymal tumor of the pelvis: A report of two cases. Oncol Lett. 2014;8(1):67-71. doi: https://doi.org/10.3892/ol.2014.2081
37. Seijas R, Ares O, Sierra J, Pérez-Dominguez M. Oncogenic osteomalacia: two case reports with surprisingly different outcomes. Arch Orthop Trauma Surg. 2009;129(4):533-539. doi: https://doi.org/10.1007/s00402-008-0808-2
38. Sidell D, Lai C, Bhuta S, et al. Malignant phosphaturic mesenchymal tumor of the larynx. Laryngoscope. 2011;129(4):1860–1863. doi: https://doi.org/10.1002/lary.21916
39. Jan de Beur SM, Miller PD, Weber TJ, et al. Burosumab for the treatment of tumor‐induced osteomalacia. J Bone Miner Res. 2021;36(4):627-635. doi: https://doi.org/10.1002/jbmr.4233
40. Ho BB, Bergwitz C. FGF23 signalling and physiology. J Mol Endocrinol. 2021;66(2):R23-R32. doi: https://doi.org/10.1530/JME-20-0178
Об авторах
С. А. ГронскаяРоссия
Гронская Софья Александровна, аспирант
eLibrary SPIN: 7624-0391
117036, Москва, ул. Дмитрия Ульянова, д. 11
О. О. Голоунина
Россия
Голоунина Ольга Олеговна, студент
eLibrary SPIN: 7793-2123
Москва
Ю. В. Буклемишев
Россия
Буклемишев Юрий Витальевич
eLibrary SPIN: 4329-4720
Москва
А. В. Хайриева
Россия
Хайриева Ангелина Владимировна
eLibrary SPIN: 4516-8297
Москва
М. В. Дегтярев
Россия
Дегтярев Михаил Владимирович
eLibrary SPIN-код: 7725-7831
Москва
Л. Я. Рожинская
Россия
Рожинская Людмила Яковлевна д.м.н., профессор
eLibrary SPIN: 5691-7775
Москва
Ж. Е. Белая
Россия
Белая Жанна Евгеньевна, д.м.н., профессор
eLibrary SPIN: 4746-7173
Москва
Дополнительные файлы
|
|
1. Рис. 1. МСКТ позвоночника пациента П. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(279KB)
|
Метаданные ▾ | |
|
|
2. Рис. 2. МСКТ костей таза | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(146KB)
|
Метаданные ▾ | |
|
|
3. Рис. 3.1. Результаты ОФЭКТ/КТ пациента П. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(351KB)
|
Метаданные ▾ | |
|
|
4. Рис. 3.2. ОФЭКТ/КТ пациента П. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(310KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Гронская С.А., Голоунина О.О., Буклемишев Ю.В., Хайриева А.В., Дегтярев М.В., Рожинская Л.Я., Белая Ж.Е. Клинический случай фосфопенической формы остеомаляции вследствие паранеопластической секреции метастатического рака предстательной железы. Остеопороз и остеопатии. 2022;25(4):43-51. https://doi.org/10.14341/osteo12948
For citation:
Gronskaya S.A., Golounina O.O., Buklemishev Yu.V., Khairieva A.V., Degtyarev M.V., Rozhinskaya L.Ya., Belaya Zh.E. A clinical case of phosphopenic osteomalacia due to paraneoplastic secretion of metastatic prostate cance. Osteoporosis and Bone Diseases. 2022;25(4):43-51. (In Russ.) https://doi.org/10.14341/osteo12948
Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































