ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
ОБОСНОВАНИЕ. В России, по данным официальной статистики, сохраняется высоким уровень консервативного лечения переломов проксимального отдела бедренной кости, особенно у лиц старших возрастных групп. В этой связи оценка эффектов предикторов летальности на этапе оказания травматологической помощи таким пациентам остается актуальной. Продолжается дискуссия относительно временного интервала влияния хирургического лечения на летальность, связанную с самим событием перелома.
ЦЕЛЬ. Оценить влияние на летальность при переломах проксимального отдела бедренной кости (ППОБК) у лиц 50 лет и старше вида лечения (оперативное или консервативное) и длительности дооперационного периода.
МАТЕРИАЛЫ И МЕТОДЫ. Проведено поперечное ретроспективное с проспективным компонентом исследование ППОБК, имевших место с 1 января по 31 декабря 2019 гг. у лиц 50 лет и старше, проживающих в городе Армавир. Численность населения старше 50 лет составляла на этот год 71 969. Для анализа летальности использовали метод Каплана-Мейера.
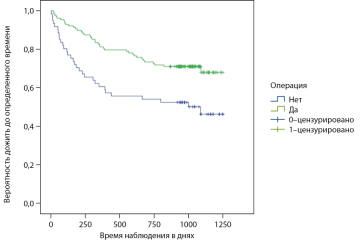
РЕЗУЛЬТАТЫ. Достоверно большая выживаемость после хирургического лечения по сравнению с консервативным обуславливалась меньшей летальностью пациентов на интервале до 240 дня (критерий Breslow (Generalized Wilcoxon, р<0,007) с момента травмы. Летальность к этому сроку была, соответственно, 11,7 против 32,7%, средняя смертность в день в пересчете на 1000 пациентов — 0,489 человека среди оперированных и 1,37 среди не оперированных. В стратифицированных по возрасту и индексу Charlson группах достоверные различия летальности отмечены только для лиц 80 лет и старше. Задержка оперативного вмешательства более 72 часов достоверно увеличивала летальность (критерий хи-квадрат Пирсона, логранговый критерий, р=0,012.
ЗАКЛЮЧЕНИЕ. Хирургическое лечение, выполненное не позднее 72 часов с момента перелома, снижает или сводит к минимуму риск смерти, связанной непосредственно с самим событием перелома, в том числе у лиц старше 80 лет. Эффект хирургического вмешательства на летальность максимально проявляется на временном интервале 6–8 месяцев после перелома.
ОБОСНОВАНИЕ. Дефицит витамина D показал значимую роль в нарушении поддержания мышечной массы и функции скелетных мышц, которые прогрессирующе снижаются у пациентов с саркопенией в пожилом и старческом возрасте.
ЦЕЛЬ. Оценить частоту и факторы риска дефицита витамина D и выявить его взаимосвязь с саркопенией у людей в возрасте 65 лет и старше.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование включены 230 человек 65 лет и старше (медиана возраста 75 [68; 79] лет). Выполнены анкетирование с определением психического статуса на этапе скрининга по опроснику Mini-Mental State Examination (MMSE), уровня физической активности по опроснику International Physical Activity Questionnaire (IPAQ). Диагностику саркопении проводили в соответствии с критериями EWGSOP2 (2018 г.). Концентрацию 25(ОН)D в сыворотке крови определяли методом иммуноферментного анализа на аппарате Architect i2000SR (Abbot, США).
РЕЗУЛЬТАТЫ. Люди с дефицитом и без дефицита витамина D не различались по возрасту, полу, уровню физической активности, статусу курения и другим социальным характеристикам (р>0,05). У лиц с недостаточным ИМТ и ожирением дефицит витамина D встречался чаще по сравнению с теми, кто имел нормальную или избыточную массу тела (р<0,001). Вероятная саркопения установлена у 64,8% участников 65 лет и старше, подтвержденная — у 28,7%, тяжелую саркопению наблюдали у 21,3% человек. Дефицит витамина D увеличивал вероятность саркопении в 4,989 (95% ДИ 1,321–12,626; р=0,0420) раза и ассоциировался со слабой мышечной силой (ОШ=2,613; 95% ДИ 1,993–3,270; р=0,00116) и низкой физической работоспособностью по результатам SPPB тестов (ОШ=1,905; 95% ДИ 1,342–2,710; р=0,00034) и теста «Встань и иди» (ОШ=1,364; 95% ДИ 1,003–1,853; р=0,047).
ЗАКЛЮЧЕНИЕ. Дефицит витамина D, установленный у 58,7% людей в возрасте 65 лет и старше, связан с недостаточным ИМТ и ожирением. У пациентов с саркопенией он выявлялся в 72,7% случаев и ассоциировался с возрастом, ИМТ менее 25 кг/м2, недостаточной физической активностью и низкой функцией скелетных мышц.
ОБОСНОВАНИЕ. При ревматоидном артрите (РА) на состояние костной ткани могут влиять различные цитокины. Для формулирования клинически значимых выводов о роли цитокинов актуальны исследования, позволяющие сформировать большие массивы данных для дальнейших метаанализов.
ЦЕЛЬ. Изучить связь минеральной плотности кости (МПК) с иммунологическими и гуморальными факторами у женщин в постменопаузе с РА.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование включены 73 женщины в постменопаузе с РА (медиана возраста 63,0 [56,0; 67,0] лет). Проведено клинико-лабораторное обследование, включавшее двухэнергетическую рентгеновскую денситометрию для оценки МПК поясничного отдела позвоночника (L1–L4), шейки бедра (ШБ) и проксимального отдела бедра (ПОБ) в целом, определение С-реактивного белка (СРБ), ревматоидного фактора (РФ), антител к циклическому цитруллинированному пептиду (АЦЦП), паратгормона (ПТГ), миостатина, фоллистатина, интерлейкина 6 (ИЛ-6), рецепторов к ИЛ-6, инсулиноподобного фактора роста 1, адипонектина, лептина, фактора роста фибробластов 23, фактора некроза опухоли (ФНО) SF12.
РЕЗУЛЬТАТЫ. При сравнительном анализе цитокинового профиля, в зависимости от наличия остеопороза, выявлены более высокие показатели адипонектина (р=0,002), ФНО SF12 (р=0,015) и рецепторов к ИЛ-6 (р=0,014). При корреляционном анализе значимые прямые корреляции между МПК всех областей измерения установлены с лептином и ИЛ-6; обратные ассоциации обнаружены между адипонектином и МПКL1–L4, фоллистатином и МПКШБ, ФНО SF12 и МПКПОБ. В линейном регрессионном анализе выявлены значимые связи между МПКL1–L4 с ПТГ (β=-0,22), адипонектином (β=-0,36) и лептином (β=0,35); МПКШБ с СРБ (β=-0,23), АЦЦП (β=-0,21), ПТГ (β=-0,35), ИЛ-6 (β=0,37) и лептином (β=0,32); МПКПОБ с СРБ (β=-0,22), АЦЦП (β=-0,24), ПТГ (β=-0,30), адипонектином (β=-0,28) и лептином (β=0,42).
ЗАКЛЮЧЕНИЕ. Проведенное исследование показало, что у женщин в постменопаузе с РА состояние костной ткани в различных отделах взаимосвязано с уровнем СРБ, АЦЦП, ПТГ, адипонектина, лептина и ИЛ-6.
НАУЧНЫЙ ОБЗОР
За почти 40-летнюю историю существования двухэнергетической рентгеновской абсорбциометрии (ДРА) основное внимание уделялось рассмотрению вопросов диагностики низкой минеральной плотности кости (МПК), т.е. остеопороза, чему было посвящено множество отечественных и зарубежных публикаций. Значительно меньше освещались проблемы, связанные с повышенной МПК и касающиеся не только сложности интерпретации результатов, но и дальнейшей тактики ведения пациентов. Чаще всего подобные случаи в рутинной клинической практике остаются незамеченными из-за орфанного характера многих заболеваний, приводящих к развитию патологически высокой плотности костной ткани, и как правило трактуются как проявление остеоартроза. Безусловно, артроз, сколиоз и иные деформации суставов (особенно в позвоночнике) являются причиной завышения МПК в большинстве клинических ситуаций. Однако костные дисплазии, проявляющиеся диффузным или очаговым повышением МПК, могут, как и остеопороз, осложняться низкотравматическими переломами; также возникают неврологические и другие осложнения, способные привести к инвалидизации. Несмотря на крайне редкую встречаемость этих заболеваний, недостаточная осведомленность врачей об особенностях клинической и рентгенологической картины и течения склерозирующих костных дисплазий может повлечь за собой ошибки при постановке диагноза, прежде всего — неверную интерпретацию результатов ДРА. В нашем обзоре ставится задача кратко описать генетически обусловленные патологии, вызывающие чрезмерное повышение МПК, с целью привлечь внимание медицинской аудитории к данной проблеме.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Аутоиммунный полигландулярный синдром 1 типа (АПС-1) — редкое моногенное заболевание с аутосомно-рецессивным наследованием. Типичными проявлениями этого синдрома являются хронический кожно-слизистый кандидоз, первичная надпочечниковая недостаточность и гипопаратиреоз. В данный статье мы представим клинический случай сочетания АПС-1 и прогрессирующей поясно-конечностной мышечной дистрофии у одного пациента. В возрасте 3 лет больному диагностирован хронический кожно-слизистый кандидоз, в 40 лет — аутоиммунная алопеция. В 43 года у пациента появились жалобы на постепенно прогрессирующую мышечную слабость. В 49 лет верифицированы первичная надпочечниковая недостаточность и гипопаратиреоз. По результатам молекулярно-генетического исследования выявлена мутация c.769C>T p.R257X в гене AIRE, на основании чего подтверждено наличие аутоиммунного полигландулярного синдрома 1 типа. На фоне проводимой терапии в течение длительного времени отмечалась стойкая медикаментозная компенсация заболевания. Тем не менее пациент продолжал отмечать постепенное прогрессирование мышечной слабости, что привело к серьезным затруднениям при ходьбе и невозможности удержания головы в вертикальном положении. По результатам расширенного неврологического обследования и полногеномного секвенирования описанные клинические проявления не представлялось возможным объединить в определенный клинический синдром, характерный для известных наследственных миопатий. Титр миозит-специфических антител — отрицательный. Попытка назначения иммуносупрессивной терапии не увенчалась успехом.
Таким образом, мы сообщаем о прогрессирующей мышечной дистрофии как одном из редких проявлений АПС-1, не связанном с аутоиммунным повреждением мышечной ткани.

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
ISSN 2311-0716 (Online)